范德瓦尔斯气体
贡献者: _Eden_
范德瓦尔斯方程是理想气体向真实气体的推广,架起了微观图像与宏观测量之间的桥梁。
范德瓦尔斯对理想气体作了两点修正:1、真实气体占据一定体积;2、真实气体间有分子间作用势(Lennard-Jones 势是一个很好的近似)。范德瓦尔斯方程展现出惊人的威力——从它的图像上可以看出气液相变线,可以找到临界点……1910 年诺贝尔物理学奖授予范德瓦尔斯,以表彰他为气体和液体状态方程所作的工作。
1. 范式方程
范德瓦尔斯方程可以写为
$b$ 是因为真实气体分子总占据一定体积而做的修正。$a$ 是考虑分子间作用力(主要是吸引力)而做的修正。这里只给出不严谨的分析计算,但给出的结果是与统计物理计算结果是一致的。
设气体分子的有效直径为 $d$,分子原本能达到的空间体积为 $V_0=\frac{1}{6}\pi d^3$,当考虑它与另一分子的碰撞时,它所能达到的空间体积减少了 $\frac{4}{3}\pi d^3$。$1\rm mol$ 气体含有 $N_A$ 个气体分子,从一个粒子的角度看,它面对 $N_A-1$ 个排斥球,而每个排斥球只有一面可能对它产生排斥,体积只能算一半:
由于分子间作用力(主要是吸引力),碰撞容受到朝向容器内的吸引力而动量减小:所以要引入内压强 $\Delta p$。内压力正比于单位时间内碰撞器壁的粒子数,又正比于粒子数密度(影响吸引力的大小),所以 $\Delta p$ 正比于 $\frac{1}{V_m^2}$,所以设这个修正量为 $a/V_m^2$,$a$ 与相互作用势有关。设分子间作用力在 $r>d$ 时为林纳德琼斯势,当 $r\le d$ 时为钢球势(势能趋向于无穷大)。当 $r>d$ 时,有 $\phi(r)=-\epsilon_0(d/r)^6$,这样经过简单的积分可以证明
2. 范德瓦尔斯等温线与相变
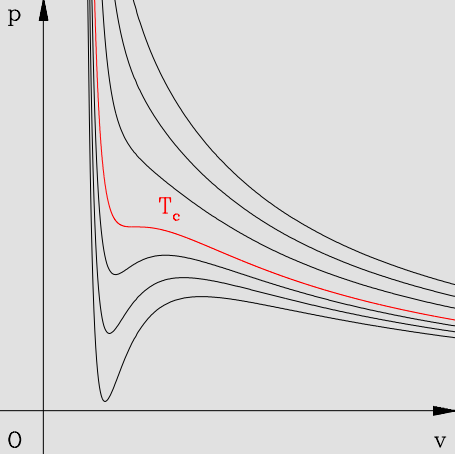
范德瓦尔斯方程描述的系统的等温线如下图:
范德瓦尔斯方程的等价形式是
这意味着在 $p-V$ 图上,一个压强 $p$ 可以对应 $3$ 个 $V$。以图 2 中的黑色等温曲线为例,当系统等温压缩从 $K$ 向 $B$ 过渡时,水蒸气的压强逐渐增大,但仍是气体。曲线 $B$ 到 $N$ 上的系统实际上是过冷气体,是亚稳态,稍加扰动后就会有液态水出现,形成水蒸气与液态水的共存态。同样地,$A$ 到 $J$ 是过热液体,稍加扰动将会产生水蒸气。因此等压水平线 $ADB$ 代表的是气液共存态,在从 $B$ 到 $D$ 到 $A$ 的等温压缩过程中,压强保持不变,水蒸气逐渐转化为液态水。到了 $A$ 点以后,水蒸气全部变为液态水,继续等温压缩,系统将沿着 $AM$ 曲线迅速 “爬升”。注意虽然 $AJDNB$ 也是范德瓦尔斯方程的解,但其中只有 $AJ$ 和 $NB$ 是亚稳态,它们分别代表过热液体和过冷气体,而 $JDN$ 曲线是不稳定地,不存在这样的系统。$ADB$ 虽然不是范德瓦尔斯方程的解,但是当前温度下稳定的气液共存态,
对于给定的温度 $T$,气液相变时的压强对应图中水平线 $ADB$ 的高度,而 $T$ 与 $P$ 之间的关系满足克拉伯龙方程。事实上,压强 $P$ 还可以由麦克斯韦等面积法则来确定,即可以证明,图中的两个阴影部分面积是相等的。那么我们就可以由范德瓦尔斯方程先得出等温线,然后根据等面积法则画出水平线 $ADB$,即可得到当前温度下发生气液相变的压强。
此外,范德瓦尔斯气体存在临界点。图中的红色曲线正是临界温度 $T_c$ 下的等温线,$C$ 点就是临界点。所谓临界温度,指的是在这一温度以上时,不再存在 $ADB$ 的气液共存态,事实上在临界温度以上,气相和液相的区别消失。这也意味着在 $C$ 处
3. 范德瓦尔斯气体的稳定性,临界点的计算
热力学系统的熵判据告诉我们,单元单相孤立系统的平衡稳定条件是
让我们进一步分析过热液体 $AJ$ 和过冷气体 $NB$ 的性质。虽然它们处于平衡稳定条件,但如果加以扰动,它们将迅速演变为气液共存态,落到 $ADB$ 水平线上。这是为什么呢?让我们研究这两个系统的某个热力学势,以亥姆霍兹自由能为判据,对于恒温恒容系统,平衡稳定态的条件为
而对于范德瓦尔斯气体的过热液体 $AJ$ 段和过冷气体 $NB$ 段,虽然满足式 7 ,但经过扰动之后越过亚稳态的势垒,可以形成另一相的核,然后将逐渐扩大范围形成两相。如图 3 所示的 $P_LS$ 段,正代表过热液体,如果发生一定的扰动使得液体中产生气相的核,位于 $S'$ 右侧。那么原先的过热液体状态也就可以逐渐向 $P_L$ 演化,从而在保证恒容的同时使自由能更小。此过程中气相核将逐渐长大,两相最终分离。这个过程被称为“成核长大”。
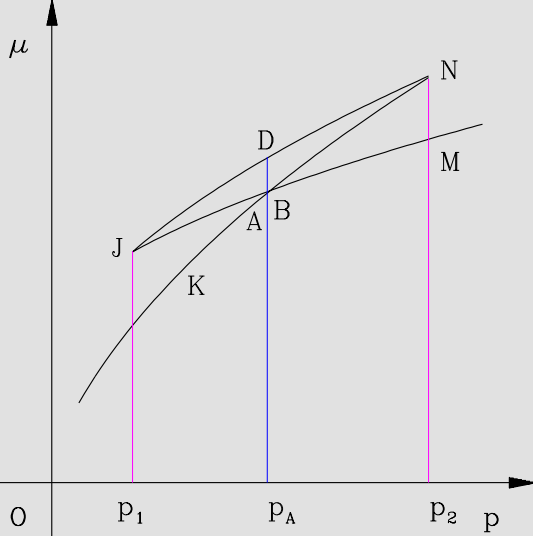
最后我们考察两相的化学势,即吉布斯自由能。利用 $ \,\mathrm{d}{\mu} =-S \,\mathrm{d}{T} +V \,\mathrm{d}{P} =V \,\mathrm{d}{P} $ 得到等温线上对应的化学势变化曲线。如图
$A,B$ 对应温度 $T$ 下相变曲线两侧的液相和气相,相变发生的压强为 $P_A=P_B$。根据相变平衡条件,两点化学势应当相等,这也要求从 $A$ 沿着 $JDN$ 到 $B$ 过程中 $V \,\mathrm{d}{P} $ 的积分为 $0$,这就意味着图 2 中两个阴影部分的面积相同。这就是麦克斯韦等面积法则。
友情链接: 超理论坛 | ©小时科技 保留一切权利