贡献者: _Eden_
1. 单元系相变平衡条件
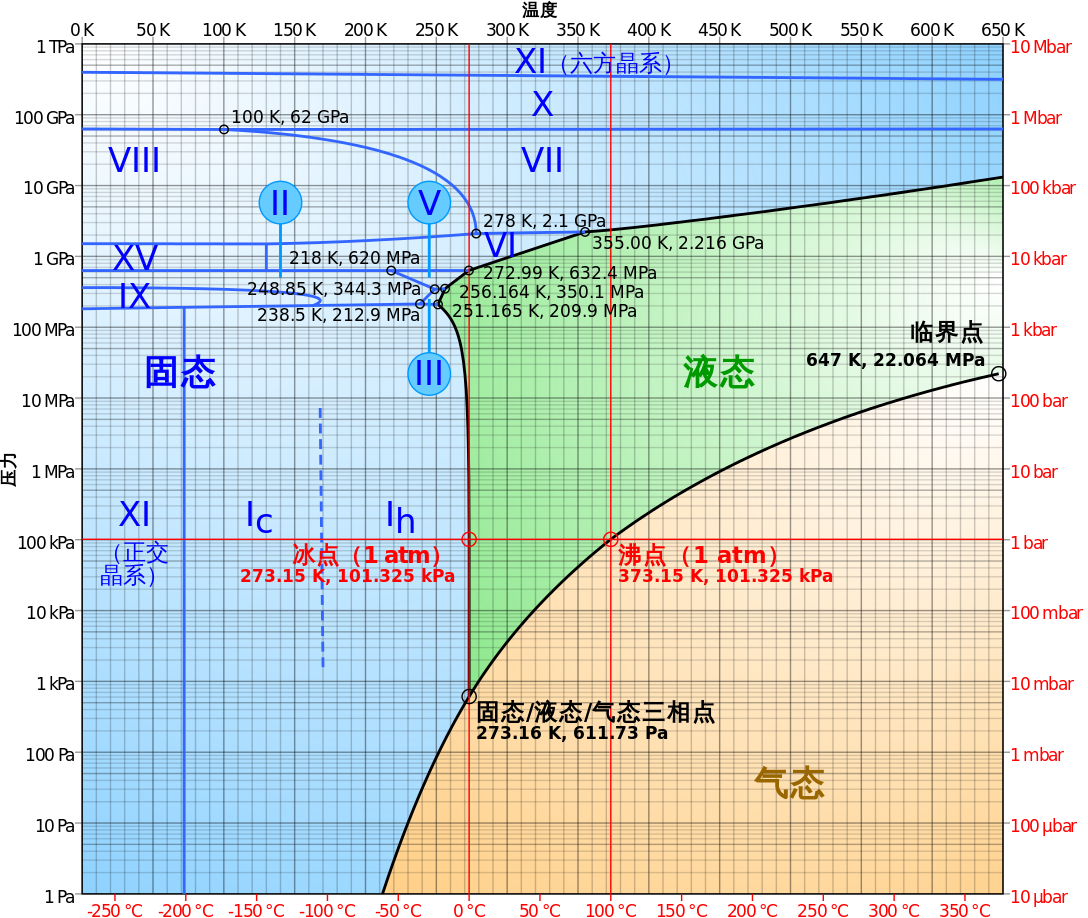
单元系的意思是系统只有一种化学组分,但有多个相。例如冰水混合物是一元二相系,水与水蒸气组成的体系是一元二相系。水的三相图(我们用 $P$-$T$ 图表示)中,有最主要的三条线区分开三个区域——固态、液态、气态(见图 1 ,图片来源自维基百科相关页面。)。
图 1:水的相图
两相分界线处是两相共存的平衡态。对于单元复相系(多个相共存),满足力学平衡和热学平衡条件(用 $\alpha,\beta$ 表示两个相):
\begin{equation}
p^{\alpha}=p^{\beta}~,
T^{\alpha}=T^{\beta}~.
\end{equation}
同一种化学组分的摩尔吉布斯函数是压强和体积的函数
式 7 。所以有化学平衡条件
\begin{equation}
\mu^{\alpha}=\mu^\beta~.
\end{equation}
被称为
相变平衡条件。
我们可以从熵判据(一个孤立系统处于平衡态,当且仅当它的熵处于极值状态,任意一个可能的微小变动(我们称为虚位移)导致的 $\delta S=0$)来更精细地分析系统的平衡条件(这帮助我们从另一个视角重新看待为什么单元多相平衡系统要满足力学平衡和热学平衡条件)。对于单元多相系中的某两相,用 $U^\alpha,V^\alpha,n^\alpha$ 表示 $\alpha$ 相的内能、体积、物质的量,对 $\beta$ 相也类似地定义 $U^\beta,V^\beta,n^\beta$。用熵判据(热动平衡判据)进行计算:
\begin{equation}
\begin{aligned}
&\delta S^\alpha=\frac{\delta U^\alpha}{T^\alpha}+\frac{P^\alpha\delta V^\alpha}{T^{\alpha}}-\frac{\mu^\alpha\delta n^\alpha}{T^{\alpha}}~,\\
&\delta S^\beta=\frac{\delta U^\beta}{T^\beta}+\frac{P^\beta\delta V^\beta}{T^{\beta}}-\frac{\mu^\beta\delta n^\beta}{T^{\beta}}~,\\
&\delta U^\alpha+\delta U^\beta=0,\delta V^\alpha+\delta V^\beta=0,\delta n^\alpha+\delta n^\beta=0~.
\end{aligned}
\end{equation}
所以 $\delta S$ 可以表示为
\begin{equation}
\begin{aligned}
\delta S
&=\delta S^\alpha+\delta S^\beta\\
&=\delta U^\alpha\left(\frac{1}{T^\alpha}-\frac{1}{T^\beta}\right)+\delta V^\alpha\left(\frac{P^\alpha}{T^\alpha}-\frac{P^\beta}{T^\beta}\right)
-\delta n^\alpha\left(\frac{\mu^\alpha}{T^\alpha}-\frac{\mu^\beta}{T^\beta}\right)~.
\end{aligned}
\end{equation}
根据熵判据,对于任何可能的虚位移(系统可能发生的微小变动),$\delta S$ 都为 $0$。由此我们可以得到三个平衡条件:
\begin{equation}
T^\alpha=T^\beta~,\ \ \ P^\alpha=P^\beta~,\ \ \ \mu^\alpha=\mu^\beta~.
\end{equation}
由此我们得出了相变平衡条件。我们可以用这一结论来解决复相系统的各种问题,例如,若一个冰水混合物系统处于相平衡,那么在这种温度压强情况下下冰的摩尔化学势一定等于水的摩尔化学势。利用这个原理,可以推出 $P$-$T$ 图上两相平衡曲线的斜率,得到克拉伯龙方程。
2. 多元系相变平衡条件
设这个多元体系的热平衡条件和力学平衡条件已经满足,温度和压强处处相等且保持不变。我们可以用吉布斯函数判据(式 5 )。考虑 $\alpha$ 相和 $\beta$ 相(每相中可能有多个组元),设系统发生一个虚变动,在这个虚变动中两相各组员的物质的量发生改变,用 $\delta n_i^\alpha,\delta n_i^\beta$ 表示。在不发生化学反应的情形下,有
\begin{equation}
\delta n_i^\alpha+\delta n_i^\beta=0 \quad(i=1,\cdots,k)~.
\end{equation}
根据多元系吉布斯函数
式 7 的全微分关系式,我们有
\begin{equation}
\delta G=\delta G^\alpha+\delta G^\beta=\sum_i (\mu_i^\alpha-\mu_i^\beta)\delta n_i^\alpha~.
\end{equation}
由于虚变动的各 $\delta n_i^\alpha$ 是任意的,所以有多元系的相变平衡条件:
\begin{equation}
\mu_i^\alpha=\mu_i^\beta~.
\end{equation}
与单元系不同的是,这里的 $\mu_i^\alpha$ 指的是在 $\alpha$ 相组元 $i$ 的偏摩尔吉布斯函数(
式 4 ),称为组元 $i$ 的化学势。
如果平衡条件不满足,则系统将发生相变。如果 $\mu_i^\alpha>\mu_i^\beta$,则变化朝着 $\delta n_i^\alpha<0$ 的方向进行。
例 1 拉乌定律
理想溶液中各组员化学势为 $\mu_i=g_i(T,p)+RT \ln\left(x_i\right) $(与理想气体 式 4 的情况类似),其中 $g_i$ 为组员 $i$ 的纯溶液化学势(或摩尔吉布斯函数)。
- 假设溶剂是非挥发性的,试证明,当溶液与溶剂的蒸气达到平衡时,相平衡条件为
\begin{equation}
g'_1=g_1+RT \ln\left(1-x\right) ~,
\end{equation}
- 溶剂的饱和蒸气压 $p$ 可看作温度 $T$ 和溶质浓度 $x$ 的函数。求证:在一定温度下,溶剂的饱和蒸气压随溶质浓度的变化率为
\begin{equation}
\left(\frac{\partial p}{\partial x}\right)_T=-\frac{p}{1-x}~.
\end{equation}
- 将上式积分得到
\begin{equation}
p_x=p_0(1-x)~.
\end{equation}
解答:
- 气相化学势就是 $g'_1$,而溶剂的摩尔分数为 $1-x$,溶剂的化学势为 $g_1+RT \ln\left(1-x\right) $。根据相平衡条件:
\begin{equation}
g'_1=g_1+RT \ln\left(1-x\right) ~.
\end{equation}
- 摩尔吉布斯函数的全微分公式为 $ \,\mathrm{d}{g} =-S_m \,\mathrm{d}{T} +V_m \,\mathrm{d}{p} $,在满足温度不变与相平衡条件下,上一问中等号两侧全微分的值应当相同,即
\begin{equation}
\begin{aligned}
\,\mathrm{d}{g} '_1= \,\mathrm{d}{g} _1-\frac{RT}{1-x} \,\mathrm{d}{x} ~,\\
V'_m \,\mathrm{d}{p} =V_m \,\mathrm{d}{p} -\frac{RT}{1-x} \,\mathrm{d}{x} ~.
\end{aligned}
\end{equation}
\begin{equation}
\left(\frac{\partial p}{\partial x}\right)_T=-\frac{RT}{V'_m(1-x)}=-\frac{p}{1-x}~.
\end{equation}
- 将微分方程移相再积分:
\begin{equation}
\begin{aligned}
\frac{ \,\mathrm{d}{p} }{p}=-\frac{ \,\mathrm{d}{x} }{1-x}~,\\
\ln p= \ln\left(1-x\right) +C~.
\end{aligned}
\end{equation}
\begin{equation}
p_x=p_0(1-x)~.
\end{equation}
在一些特殊的多元系例子中,力学平衡条件或热平衡条件可能不满足。例如膜平衡问题,一种生物细胞膜不让糖分子度过,只允许水分子度过,则它的两侧会产生压强差(渗透压)。此时水分子能透过半透膜,两侧仍满足热学平衡条件,两侧温度相同,且水要满足化学平衡条件(两侧的偏摩尔吉布斯函数相等):
\begin{equation}
\mu_\text{水}^\alpha=\mu_\text{水}^\beta~.
\end{equation}
通过这个公式,可以得出渗透压与糖水浓度的关系式。如下面这个例子。
例 2 半透膜
设一个开口玻璃管底端有半透膜将管中糖的水溶液与容器内的水隔开,半透膜只让水透过,不让糖透过。实验发现,糖水溶液的液面比容器内水的液面上升一个高度 $h$。这意味着膜的两侧存在压强差(渗透压):$p-p_0=\rho gh$。
设 $g(T,P)$ 为纯水的摩尔吉布斯函数(纯水的化学势)。根据拉乌定律,糖水中水组分的化学势就是
\begin{equation}
\mu(T,P)=g(T,P)+RT \ln\left(1-x\right) ~.
\end{equation}
由相变平衡条件,有
\begin{equation}
g(T,P)+RT \ln\left(1-x\right) =g(T,P_0)~,
\end{equation}
$x$ 是糖水中糖的摩尔分数。如果 $x\ll 1$,那么两侧的压强差 $p-p_0$ 也远小于 $p$。所以
\begin{equation}
\begin{aligned}
&(g(T,P)-g(T,P_0))\\
&= \left(\frac{\partial g}{\partial P} \right) _{T} (P-P_0)=V_m(P-P_0)\\
&=-RT \ln\left(1-x\right) \approx RT x\approx RT n_2/n_1~.
\end{aligned}
\end{equation}
上式中 $n_2$ 为糖的摩尔分数,$n_1$ 为糖水中水的摩尔分数。由于 $x\ll 1$,所以 $x\approx n_2/n_1, n_1V_m\approx V$,$V$ 是糖水的总体积。因此我们有渗透压方程
\begin{equation}
P-P_0\approx\frac{n_2RT}{V}~.
\end{equation}
致读者: 小时百科一直以来坚持所有内容免费无广告,这导致我们处于严重的亏损状态。 长此以往很可能会最终导致我们不得不选择大量广告以及内容付费等。 因此,我们请求广大读者
热心打赏 ,使网站得以健康发展。 如果看到这条信息的每位读者能慷慨打赏 20 元,我们一周就能脱离亏损, 并在接下来的一年里向所有读者继续免费提供优质内容。 但遗憾的是只有不到 1% 的读者愿意捐款, 他们的付出帮助了 99% 的读者免费获取知识, 我们在此表示感谢。