压强体积图
贡献者: addis; _Eden_; FFjet
- 本文处于草稿阶段。
根据理想气体状态方程,我们可以得知给定量的理想气体的宏观状态只有两个自由度。在例 1 中我们说到可以在压强 $P$,体积 $V$,温度 $T$ 等宏观量中任取两个来作为该系统的状态量,完全确定系统的宏观状态。而最常见的作法是取压强和体积 $P,V$。于是自然地,我们可以用一个二维直角坐标系 $P$-$V$ 中的一点来描绘理想气体某时刻的状态及其变化,称为压强体积图。该平面就是理想气体的(宏观)状态空间。注意在讨论 $P$-$V$ 上的状态变化时,我们往往假设气体始终处于准平衡的状态。
对于其他的气体模型(如范德瓦尔斯气体),虽然状态方程与理想气体不同,但以上讨论仍然成立,所以同样可以用 $P$-$V$ 图描述其状态的变化。
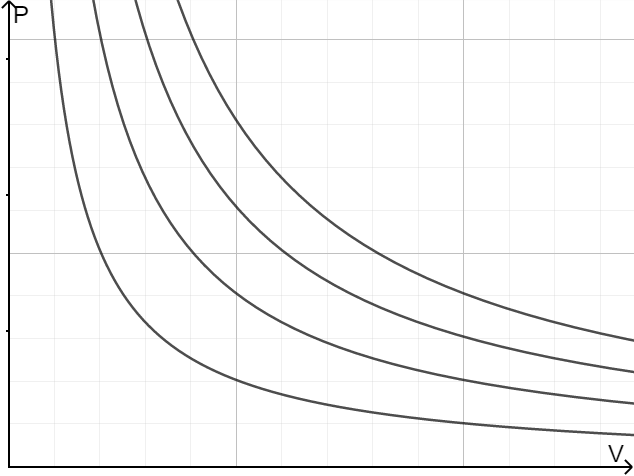
1. 等温线
为了直观地表现它们的关系,我们可以借助压强体积图,在上面画出一条曲线——曲线上每个点表示在当前温度下不同压强所对应的不同体积。
等温线帮助我们分析压强、体积与温度的关系。例如图 1 中等温线是反比例函数,意味着理想气体在同一温度下压强与体积成反比。
2. 压强体积图与做功
体积、压强与做功
现有一个体积 $V$ 可变的容器,在容器壁上可以安装探测器来测量内部气体的压强 $P$。只要气体处于平衡态,气体的压强就处处相等。现在我们考虑这样一个问题——改变容器的体积,需要对容器做多少功(或者容器对外界做多少功)?
假设容器是长方体,横截面是 $S$,那么这块面上受气体压强的力为 $P\cdot S$。如果改变长方体的体积,使它长度增加 $\Delta x$(假设在这个过程中压强变化不大),那么气体对外做功为 $F\cdot \Delta x=P\cdot S\Delta x=P\Delta V$。于是我们得出结论 $\Delta W=P\Delta V$,这不仅对长方体容器成立,对任意形状的容器都成立。
压强体积图上任意曲线的做功
由于容器在改变体积的过程中,气体的压强可以发生变化,在一个复杂过程中做功不能用简单的 $P\Delta V$ 概括,但我们却可以划分为无穷多个小过程,每一个小过程中压强变化不大,做功近似地可以看成是 $P\Delta V$。这样一来,总的做功就是 $P \,\mathrm{d}{V} $ 的积分了。
图像可以帮助我们方便地分析这个问题。对于 $P-V$ 图中的一条曲线,设容器从点 $1$ 沿着曲线变化到点 $2$——曲线上每一个点表明了气体在当时的体积和压强。
如图 3 所示,做功
由积分关系式可得,做功就是 $P$-$V$ 曲线下方的面积,也就是图中标注的阴影部分的面积。
如图 4 所示,如果是一个闭合路径,在气体状态沿着它走的过程中,对外做功就是闭合路径围出的面积(顺时针为正)。