节流过程
贡献者: _Eden_
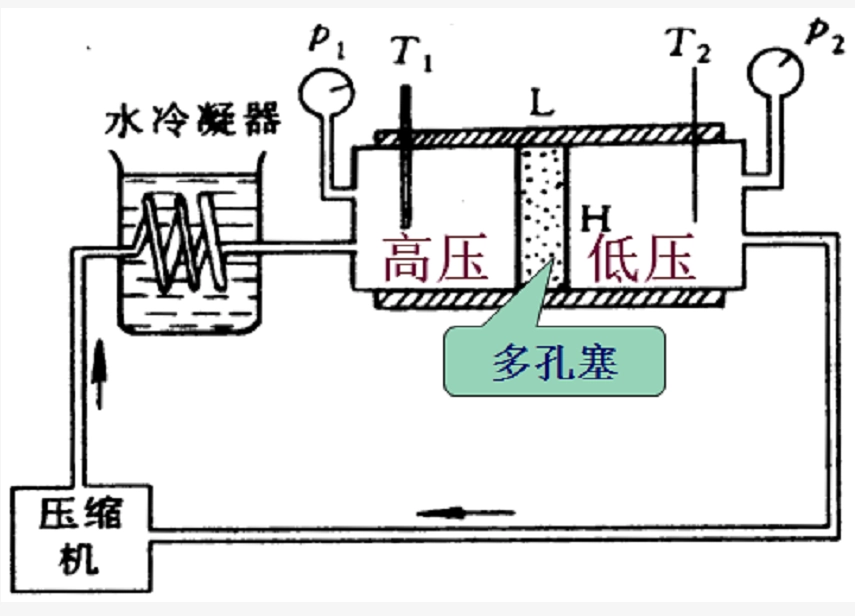
绝热条件下,气体从高压的一边经过多孔塞不断地流到低压的一边,并达到定常状态;多孔塞两边各维持着较高的气压 $P_1$ 和较低的气压 $P_2$,这个过程叫做节流过程。
由于整个过程是绝热的,所以 $\Delta Q=\Delta U+P\Delta V=0$。设气体在通过多孔塞前内能为 $U_1$,体积为 $V_1$,通过多孔塞后内能为 $U_2$,体积为 $V_2$,那么 $U_2-U_1+P_2V_2-P_1V_1=0$,即 $U_2+P_2V_2=U_1+P_1V_1$。我们可以定义系统的另一状态函数:焓 $H=U+PV$。那么 $H_1=H_2$,在节流过程前后气体的焓值相等。
现在我们要研究在节流过程中,气体降温 $\Delta T$ 与压强的变化 $\Delta P$ 的关系。由于是等焓过程,我们可以定义焓不变的条件下气体温度随压强的变化率,称为焦汤系数:
将状态函数 $H$ 看成 $T,P$ 的函数 $H(T,P)$,那么
最后一个等号可以由焓的方程式 19 推出。对理想气体来说,等压膨胀系数 $\alpha=\frac{1}{T}$,焦汤系数为 $0$,气体没有降温。这个结果并不出人意料,因为理想气体的分子间没有互相作用力,内能只是温度的函数,而且 $p_1V_1=p_2V_2$,等焓过程就是等内能过程,也是等温过程。
但对于一般气体,例如范德瓦尔斯气体,若 $\alpha T>1$,有 $\mu>0$,当气体从高压区经过多孔塞到低压区就会降温。从能量转换的角度看,气体在膨胀的过程中分子相互作用势增加,一部分分子动能转换为相互作用势,所以气体温度降低。
友情链接: 超理论坛 | ©小时科技 保留一切权利