电子轨道与元素周期表
贡献者: ACertainUser; addis
- 本文存在未完成的内容。
在这里,用最简单的方式介绍原子的壳层结构,并解释元素周期表如何根据壳层结构分出每个周期。在玻尔原子模型 中,电子轨道如图 1 。目前,“原子轨道”、” 电子轨道”、“原子轨域”、“电子轨域” 一般是同义词。1
1. 电子轨道
| 名称 | 符号 | 取值 |
| 电子层 | 主量子数 n | 1(K), 2(L), 3(M), 4(N).。 |
| 电子亚层 | 角量子数 l | 0(S),1(P),2(D),3(F),..., n-1 |
| 亚层的轨道 | 磁量子数 m | -l, -l+1,...,0,1,2,...,l-1,l |
| (电子自旋) (这不是轨道参数) | -1/2, 1/2 |
电子层:如图 1 所示,从半径最小的轨道开始,用数字 1,2,3 (或 K,L,M,...)等依次命名每条轨道,这些数字也叫主量子数,用 $n$ 来表示。
电子亚层:一个电子层可以细分为若干个电子亚层,以角量子数 $l$ 计。对于一个主量子数为 $n$ 的电子层,角量子数 $l$ 可以取 $0,1,2,...,n-1$(或称 $S,P,D,F...$)等 $n$ 个不同的值,即一个主量子数为 $n$ 的电子层可以分为 $n$ 个电子亚层。把行标和列标组合起来,就能得到任意一个格子的名称,例如第三行第二列的格子叫做 $3P$。例如,$n=3$ 的电子层包括 $3S, 3P, 3D$ 三个亚层。
亚层的轨道:一个电子亚层可以再继续细分为若干个轨道,以磁量子数 $m$ 计。对于一个角量子数为 $l$ 的电子亚层,磁量子数 $m$ 可以取 $ - l, - l + 1...0,...l - 1,l$ 等 $(2l + 1)$ 个不同的值,即一个角量子数为 $l$ 的电子亚层可以分为 $(2l+1)$ 个轨道。例如,$l=1$ 的 P 亚层包括 $P_x, P_y, P_z$ 三个轨道。
电子自旋:由于不相容原理,一个亚层的轨道中最多只能容纳两个(自旋相反的)电子。
综上所述,每一个电子亚层可以最多容纳 $2(2l+1)$ 个电子,每一个电子层最多容纳 $2n^2$ 个电子(见图 3 )。
2. 电子轨道的表达法
现在我们简要说明一下书写电子轨道的一般方法(至于电子为什么这么排布,见下文)。
对于一个电子亚层,我们先写电子层(主量子数 $n$),再写电子亚层(角量子数 $l$,记为 $S, P,D,F,...$),最后以上标标注该电子亚层上的电子数量。例如,$3S^2$ 指 $n=3$ 的电子层的 S 电子亚层 $l=0$ 上有 2 个电子。
对于一个原子的电子排布,我们一般按能量从小到大的顺序,依次表示各电子亚层。例如,第六号元素 C(碳)的电子排布是 $1S^2 2S^2 2P^2$。
如果一个原子的周期比较大,我们可以省略内层电子,以相应稀有气体的电子排布代替,称为 “原子实”。例如,第十号元素 Ne(氖)的电子排布是 $1S^2 2S^2 2P^6$,第十一号元素 Na(钠)的电子排布 $1S^2 2S^2 2P^6 3S^1$,那么 Na 的电子排布还可记为 $[Ne] 3S^1$. 同理,18 号元素 Ar(氩)的电子排布是 $1S^2 2S^2 2P^6 3S^2 3P^6$,那么 20 号元素 Ca(钙)的电子排布也可以记为 $[Ar] 4S^2$.(或许你很好奇 $n=3$ 电子层的 $l=2 (D)$ 的电子亚层去哪了,别急,见下文)
这种书写方法不仅让电子的排布更为整洁、也突出了原子的最外层电子排布,而这往往与元素的化学性质密切相关(就是对新人不大友好)。
3. 电子排序的规律
到此为止,每条轨道承载电子的数目已经解释清楚了,但是应该如何把电子往格子里面放呢?总的原则是使电子总能量最小(这种状态叫做原子的基态)。一般而言,电子能量随 $n$ 与 $l$ 的增大而增大,但这种规则十分不严格(见下),原子轨道的能量事实上非常复杂。
对于氢原子(1 个核外电子),显然电子应该放在 $1S$ 格子里,氦原子(2 个核外电子)可以把两个电子都放在 $1S$ 格子里,从而把 $n=1$ 的轨道填满,这就是第一周期的两个原子的电子分布。对于锂原子(3 个核外电子)可以在氦原子的基础上往 $2S$ 格子里放一个电子。
但奇怪的是,轨道的能量并不是简单的单调递增,而是如下图中的箭头所示的 $1S, 2S, 2P, 3S, 3P, 4S, 3D, 4P, 5S\dots$ 的顺序。
理论上,$n\ge5$ 的电子层存在 $l\ge4$ 的电子亚层,但实际的基态原子中,该电子亚层能量太高,一般不被填充。(至少对于 118 号 Og 及之前的元素,这也是目前大多数元素周期表上所列出的最后一号元素)
其余的一些规律
这里列出电子排布的部分规律。不过要注意的是,这些规律不总是成立(至少在前三周期成立)。
| 5 B | $\uparrow$ | ||
| 6 C | $\uparrow$ | $\uparrow$ | |
| 7 N | $\uparrow$ | $\uparrow$ | $\uparrow$ |
| 8 O | $\uparrow \downarrow$ | $\uparrow$ | $\uparrow$ |
| 9 F | $\uparrow \downarrow$ | $\uparrow \downarrow$ | $\uparrow$ |
| 10 Ne | $\uparrow \downarrow$ | $\uparrow \downarrow$ | $\uparrow \downarrow$ |
例如,23V(钒)的电子排布是 $4S^2 3D^3$,那下一号元素 24Cr(铬)的电子排布是 $4S^2 3D^4$?非也,由于半满的 S、D 亚层更稳定,因此 24Cr(铬)的电子排布是 $4S^1 3D^5$。
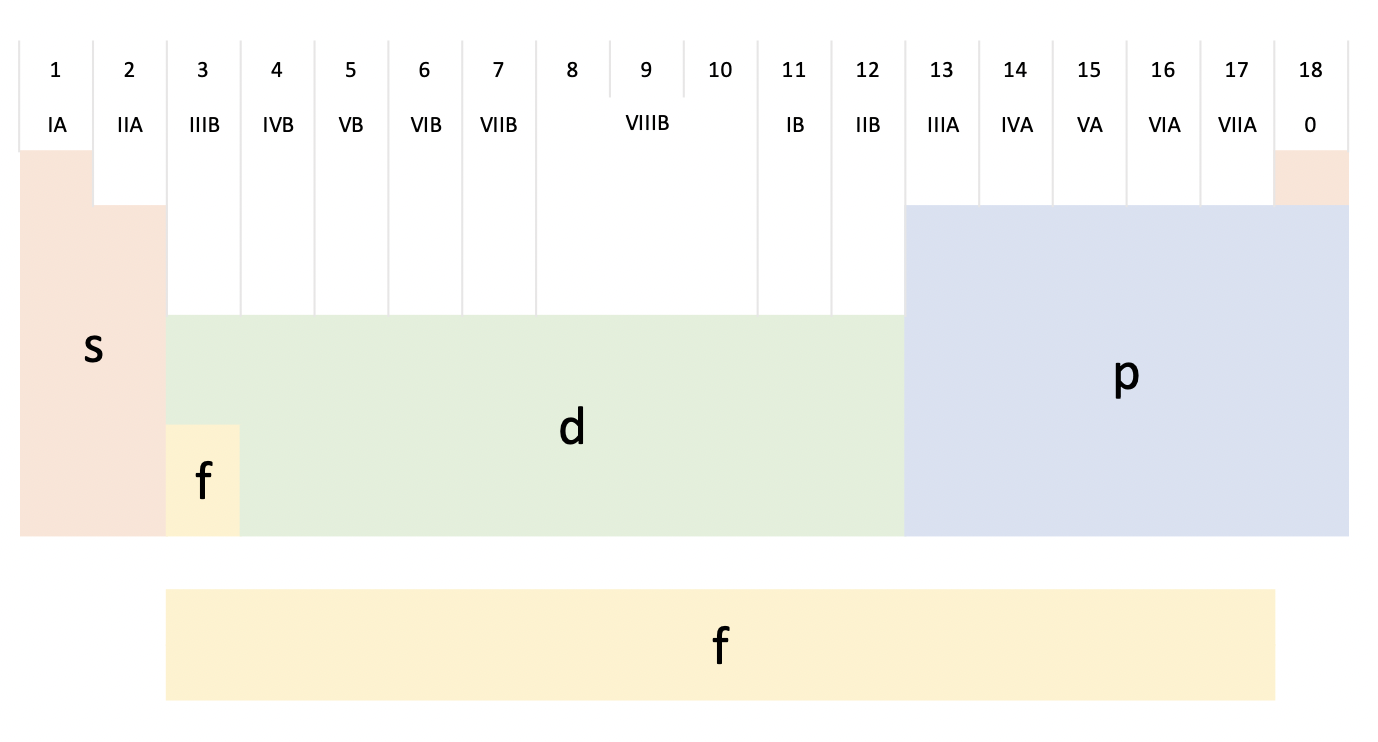
4. 元素周期表的排序
元素原子中最大的主量子数 $n$(最高的电子层数)确定了该元素所在的周期。例如 30 号元素 Zn(锌),可以按照上图绿色线条的顺序占满 $1S, 2S, 2P, 3S, 3P, 4S, 3D$(这些格子能容纳的总电子数刚好是 30)。其中 $4S$ 的主量子数最大,$n=4$,所以 30 号元素在第四周期。按照这个规律,把上图按照周期分类如下。
再主要根据元素原子最高能量的电子亚层,可以进一步划分元素周期表为 s 区,p 区,d 区,f 区等。其中 s,p 区一般合称主族,d,f 区合称副族。有人把 IB, IIB(11,12)列合称为 ds 区。
1. ^ 有人更偏好 “轨域” 而不是 “轨道”。波尔模型是一个非常直观的模型,但不大符合实际。根据量子力学,电子在原子附近其实没有非常明确的 “轨道”,而是以某种概率分布在原子核周围。
[1] ^ David Griffiths, Introduction to Quantum Mechanics, 4ed