克拉伯龙方程
贡献者: _Eden_
- 本文处于草稿阶段。
1. 克拉伯龙方程
单元系两相平衡共存时,必须满足式 5 的 $T^\alpha=T^\beta=T,P^\alpha=P^\beta=P,\mu^\alpha(T,P)=\mu^\beta(T,P)$ 三个条件。其中相平衡条件中摩尔化学势 $\mu$ 可以看作是温度和压强的函数。此时,相变温度 $T$ 对应着压强 $P$(在压强 $P$ 的环境下,相变温度为 $T$)。
现在考虑系统的温度和压强有改变量 $ \,\mathrm{d}{T} , \,\mathrm{d}{P} $,要使得两相仍处于平衡条件,就有
由于化学势就是摩尔吉布斯函数,所以 $ \,\mathrm{d}{\mu} =-S_m \,\mathrm{d}{T} +V_m \,\mathrm{d}{P} $($S_m$ 为摩尔熵,$V_m$ 是摩尔体积)。由 $ \,\mathrm{d}{\mu} ^\alpha= \,\mathrm{d}{\mu} ^\beta$ 可以推出
在实验上熵是不能直接测量的,但我们知道在可逆过程中 $\Delta Q=T\Delta S$。考虑 $1\rm mol$ 物质从 $\alpha$ 相转变到 $\beta$ 相所吸收的相变潜热,由于相变时物质温度不变,有 $L=T(S_m^\beta-S_m^\alpha)$。可以得到克拉伯龙方程:
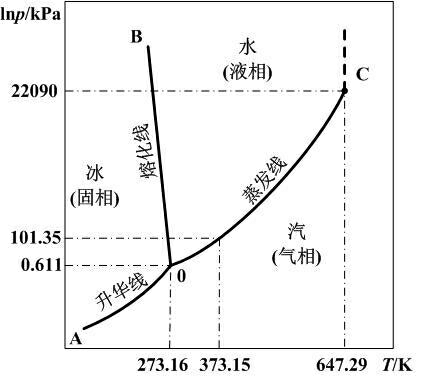
相平衡曲线的斜率通常是正的,但也存在例外:从水的三相图中看到,水的熔化线斜率 $ \,\mathrm{d}{p} / \,\mathrm{d}{T} <0$。而水的摩尔体积比冰的摩尔体积小,密度比冰大,代入克拉伯龙方程确实能得到熔化曲线斜率小于 $0$ 的结果。
2. 饱和蒸气压方程
由克拉伯龙方程可以得出在气相 $\beta$ 与凝聚相(液相或固相)$\alpha$ 之间的相变方程,可以得到饱和蒸气压与温度的关系,也就是饱和蒸气压方程。现在做粗略的近似,如果将气相看作理想气体,那么由 式 4 可得
再做更粗糙的近似,将相变潜热 $L$ 认为是与温度无关。那么可以积分得:
3. 二级相变的爱伦费斯特方程
爱伦费斯特(Ehrenfest)试图对相变进行分类:因为 $S_m=\frac{\partial \mu}{\partial T},V_m=\frac{\partial \mu}{\partial P}$,爱氏将一级相变概括为化学势连续、但化学势的一级偏导数在两相存在突变的相变。对与这一类相变,$S_m^\alpha\neq S_m^\beta,V_m^\alpha\neq V_m^\beta$,克拉伯龙方程适用。。
但在气液通过临界点的转变、铁磁顺磁的转变等过程中,既没有 $S_m$ 的突变(也就是说不存在相变潜热),又没有 $V_m$ 的突变。在这些过程中,化学势的一级偏导数连续,但化学势的二级偏导数不连续。爱氏将它归类为二级相变。
对于二级相变,容易得出压强与温度的新变化关系,爱伦费斯特方程: