表皮生长因子受体
编辑表皮生长因子受体(Epidermal growth factor receptor, EGFR)是一种负责与表皮生长因子(EGF)结合的跨膜受体蛋白,具有酪氨酸激酶活性,与EGF结合后可通过多条信号通路促进细胞分裂与增殖。表皮生长因子受体是由美国生物化学家斯坦利·科恩(Stanley Cohen)在发现表皮生长因子时一并发现的,科恩也因此荣获1986年诺贝尔生理与医学奖。[1]近年来,表皮生长因子受体被发现与许多癌症的发生和进展有着密切联系,针对表皮生长因子受体的抑制剂也成为了抗癌领域的研究热点。
1 结构和机理编辑
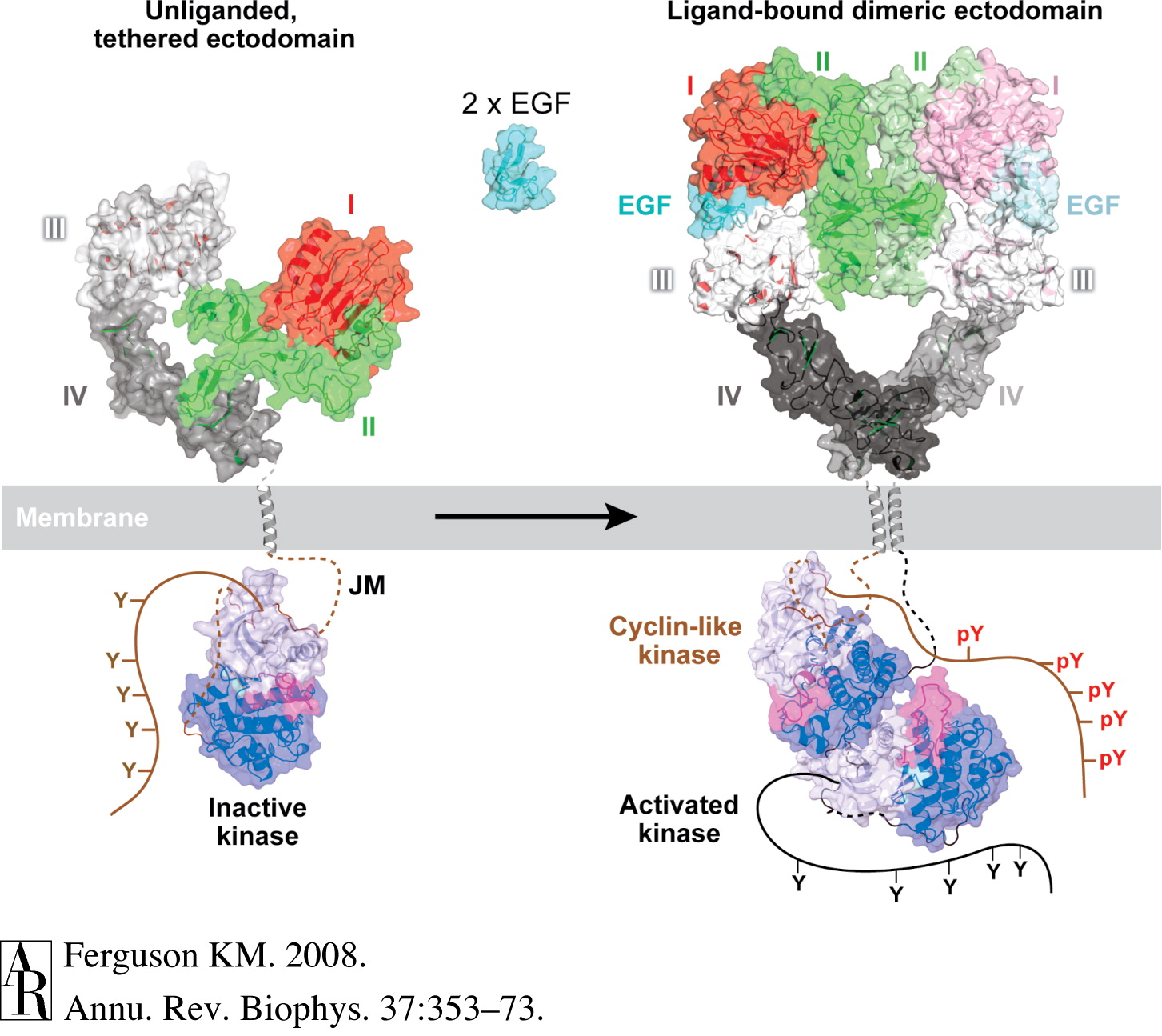
作为一种单次跨膜蛋白,表皮生长因子受体的结构可以大致分为三个部分。其胞外部分含623个氨基酸,负责与EGF等配体结合,跨膜部分含23个氨基酸,负责耦联胞外部分和胞内部分,胞内部分含542个氨基酸,活化后具有激酶催化活性并可以与其他胞内蛋白接触,触发下游信号通路。[2]由于单次跨膜蛋白的特殊性,EGFR的完整结构目前仍未能被解析。虽然如此,科学家仍通过X射线晶体衍射、NMR等一系列手段分别对其胞外、胞内和跨膜结构域进行了大量的结构分析,并拼凑出一张较为完整的画面。
EGFR在未与配体结合时主要以单体形式存在于细胞表面。当EGFR与EGF结合后,EGFR的胞外部分形成对称的二聚体,并通过跨膜部分诱导EGFR的胞内部分形成非对称的二聚体,其中一个EGFR的胞内部分被活化并产生激酶(可以使氨基酸磷酸化)活性,并导致另一个EGFR的胞内部分磷酸化。被磷酸化的这个EGFR的胞内部分可以接下来被含SH2/PTB结构域的蛋白识别,并激活一系列下游信号通路。[3]
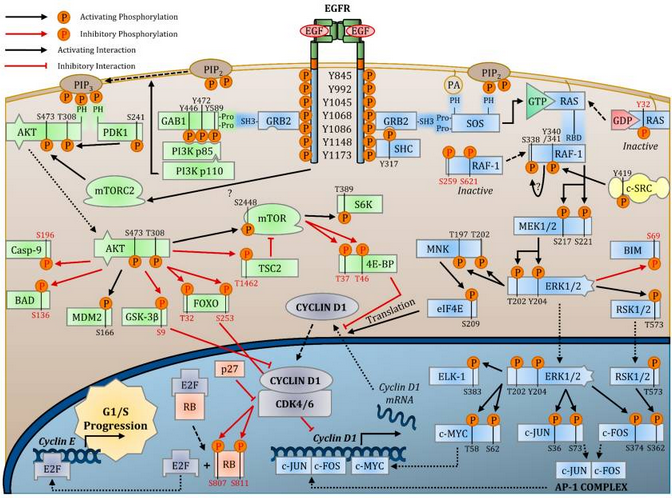
EGFR调控的下游信号通路非常广泛且复杂,其中研究的较多的有RAS-RAF-MEK-ERK通路(又称MAPK通路)、PI3K-AKT-mTOR通路、PLC-γ1-PKC通路等。其中,MAPK通路的调节功能主要是通过活化促分裂基因的转录因子,增加促分裂基因(如CYCLIN-D1)的表达,从而实现促进细胞分裂的作用。而在PI3K-AKT-mTOR通路中,作为细胞能量感受器的mTOR活性增加,导致一系列能量代谢途径的改变(如肿瘤细胞中的Warburg效应),从而满足细胞快速分裂所需的能量供应。[2]正因为EGFR可以从许多角度促进细胞分裂和增殖,EGFR的活性变化在许多癌症的发生或进展中起到了关键作用,使得EGFR成为了抗肿瘤药物研发的热门靶点。
2 生理功能和病理作用编辑
表皮生长因子受体在正常个体的生长和发育中有着广泛的生理功能,例如乳腺发育[4]、骨生长[5]、皮肤损伤修复[6]、口腔黏膜损伤修复[7]等。因此,接受EGFR抑制剂治疗的患者较容易出现皮肤不良反应,包括皮疹/痤疮样皮疹、皮肤干燥、瘙痒和指甲/甲周组织的炎症等。[8]另外,口腔黏膜炎症也是EGFR抑制剂的常见副作用之一。[8]
在癌症的病理中,表皮生长因子受体扮演了重要的角色。有研究表明,在东亚裔人群中,约35%到50%的肺癌患者携带EGFR突变。EGFR突变在非小细胞肺癌,尤其是肺腺癌中最为多见。另外,EGFR突变也更常见于非吸烟者肺癌和年轻肺癌患者中。[9]在结直肠癌中,有报道称60%到80%存在EGFR上调。[10]在胶质母细胞瘤(一种高度恶性的脑癌)中,约50%存在EGFR过表达,另外许多胶质母细胞瘤中还存在一种特殊的EGFR突变(EGFRvIII),该突变导致EGFR无需配体活化便可自发维持活性。[11]在头颈部鳞癌中,约80%到90%存在EGFR过表达。[12]总的来说,约30%的上皮系统肿瘤都与EGFR的突变、过表达或失调密切相关。[13]
3 相关药物研究编辑
3.1 EGFR抑制剂
由于表皮生长因子受体在癌症中扮演的重要作用,近些年来,有很多针对EGFR的抑制剂进入临床应用。根据作用机理的不同,这些抑制剂大体可以分为两类。第一类抑制剂主要包括针对EGFR胞外结构域的人源化单克隆抗体,它们的作用是阻止配体(如EGF)同EGFR接触,从而减少EGFR被激活的程度。[2]目前美国药监局(FDA)批准的这类抑制剂有西妥昔单抗(Cetuximab)、帕尼单抗(Panitumumab)、耐昔妥珠单抗(Necitumumab)等。[3]另一类EGFR抑制剂是针对EGFR胞内结构域的酪氨酸激酶抑制剂(TKI),它们通常与EGFR的ATP结合位点结合,从而竞争性阻止ATP在该位点结合,导致EGFR无法催化氨基酸磷酸化(即阻止了激酶活性),从而阻止了下游信号传导。[2]这一类抑制剂大部分是小分子,目前FDA批准的有厄洛替尼(Erotinib)、拉帕替尼(Lapatinib)、吉非替尼(Gefitinib)、奈拉提尼(Neratinib)等。[3]
3.2 耐药性问题
虽然各种EGFR抑制剂的出现一定程度上改善了很多晚期肿瘤患者的预后,但几乎所有的EGFR抑制剂都会在使用一段时间后出现明显的耐药性,从而导致EGFR抑制剂对晚期肿瘤患者的5年生存率改善并不明显。[4]癌细胞对EGFR抑制剂产生耐药性的途径有很多,主要包括以下几种机制[5]:
EGFR的过度表达或配体过度表达。耐药肿瘤细胞可以在细胞表面产生更多的EGFR,或者激活EGFR的配体(如肿瘤生长因子TGF-α)过度表达,使得需要更大剂量的抗体才能阻止EGFR被活化。
EGFR的变体EGFRvIII。该变体为一截短的EGFR,使得其无需配体活化便可自带激酶活性。有研究表明该变体的出现与耐药性有关。
EGFR下游或旁路的信号通路上调。EGFR的下游通路或其他旁路,如RAS、PTEN等蛋白质发生活性增加的突变,抵消了EGFR被抑制的效果。
EGFR的ATP结合位点发生突变,导致原来的小分子抑制剂无法有效阻止其激酶活性。这是导致酪氨酸激酶抑制剂耐药的主要原因。例如,在TKI治疗中,EGFR的T790M突变占病人获得性耐药的50%以上。[6]
EGFR抑制剂导致mTOR活性改变,促进自噬,提高肿瘤细胞适应性。mTOR作为EGFR下游的重要一员,其本身在维持细胞能量代谢中具有重要作用。mTOR活性变化可促使细胞通过增强自噬等途径逃过被“饿死”的命运。
针对不同的耐药机理,研究人员采用了一系列不同的策略来降低EGFR的耐药性问题。对于EGFR的ATP结合位点突变导致的耐药,通过对这一位点的结构解析,借助计算机模拟等药物设计工具,研究人员可以不断地设计出可以结合EGFR突变体的新型酪氨酸激酶抑制剂,如奥希替尼(Osimertinib)。[7]对于EGFR下游通路或旁路上调导致的耐药,可以通过联合其他靶向药的方式,同时抑制多个通路,以起到最大化杀死癌细胞的效果。[8]另外,利用药物载体同时递送EGFR抑制剂和其他小分子化疗药物可更精确地实现对癌细胞的定向打击,同时减少副作用。[9]
3.3 医学成像中的应用
作为一种在许多肿瘤细胞表面大量表达的分子,EGFR也可以被用于识别肿瘤的标记物,从而应用在肿瘤的医学成像中。将造影剂连接在EGFR抑制剂(小分子或抗体)上,当该分子与EGFR结合后,即可以实现对肿瘤的特异性识别和成像。根据成像原理的不同,研究人员开发了许多不同的EGFR选择性造影剂。例如,将厄洛替尼和纳米氧化铁颗粒共价结合,可以制成对肿瘤选择性成像的核磁共振造影剂。[10]而碳-11标记过的厄洛替尼可以用于正电子发射断层扫描,有助于筛选适用于EGFR抑制剂治疗的癌症患者,从而实现肿瘤的个体化治疗。[11]西妥昔单抗则通常用Zr-89标记后,用于正电子发射断层扫描成像,该造影剂已进入临床试验阶段。[12]另外,通过将化疗药物、造影剂和抗EFGR抗体连接在一起,可以同时实现肿瘤的诊断和靶向治疗的一体化。[10]
参考文献
- [1]
^Physiology or Medicine Nobel Prize 1986..Nobel prize.
- [2]
^Epidermal Growth Factor Receptor Cell Proliferation Signaling Pathways..NCBI.
- [3]
^Structure-Based View of Epidermal Growth Factor Receptor Regulation..Annual Review of Biophysics.
- [4]
^Mammary Gland Growth Factors: Roles in Normal Development and in Cancer..NCBI.
- [5]
^The EGFR network in bone biology and pathology..Cell Press.
- [6]
^EGFR enhances early healing after cutaneous incisional wounding..NCBI.
- [7]
^Unraveling the role of epidermal growth factor receptor in oral lesions: Key to non surgical treatment modes..World Journal of Stomatology.
- [8]
^EGFR-TKI不良反应管理专家共识。.NCBI.
- [9]
^Epidermal Growth Factor Receptor in Lung Cancer..EGFResisters.
- [10]
^Colon cancer and the epidermal growth factor receptor..NCBI.
- [11]
^Epidermal growth factor receptor (EGFR) and EGFRvIII in glioblastoma (GBM)..NCBI.
- [12]
^Overexpression of EGFR in Head and Neck Squamous Cell Carcinoma Is Associated with Inactivation of SH3GL2 and CDC25A Genes..PLoS One.
- [13]
^Activation of Epidermal Growth Factor Receptor Is Required for NTHi-Induced NF-κB-Dependent Inflammation..NCBI.
暂无