化学极性
编辑在化学中,极性是电荷的分离,导致分子或其化学基团具有电偶极矩,具有带负电荷的末端和带正电荷的末端。
极性分子必须含有极性键,因为键合原子之间的电负性不同。具有两个或多个极性键的极性分子必须具有至少在一个方向不对称的几何形状,以便键偶极不会相互抵消。
极性分子通过偶极-偶极分子间力和氢键相互作用。极性是许多物理性质的基础,包括表面张力、溶解度、熔点和沸点。
1 键的极性编辑
并非所有的原子都以相同的力吸引电子。一个原子对其电子施加的“拉力”的大小被称为电负性。电负性高的原子——如氟、氧和氮——比电负性低的原子(如碱金属和碱土金属)对电子施加更大的拉力。在一个键中,这导致原子之间电子的不平等共享,因为电子将被拉得更靠近电负性更高的原子。
因为电子带有负电荷,所以键中电子的不平等共享导致了电偶极的形成:正电荷和负电荷的分离。因为在这种偶极子中分离的电荷量通常小于基本电荷,所以它们被称为部分电荷,表示为δ+(δ正)和δ(δ负)。这些符号是克里斯托弗·英戈尔德爵士和伊迪丝·希尔达博士(乌瑟伍德)于1926年引入的。[1][2] 键偶极矩是通过将分离的电荷量和电荷量之间的距离相乘来计算的。
分子中的这些偶极可以与其他分子中的偶极相互作用,产生偶极-偶极分子间力。
1.1 分类
键可以处于两个极端之一——完全非极性或完全极性。当电负性相同,因此相差为零时,就产生了完全非极性键。完全极性键更准确地称为离子键,当电负性之间的差异大到足以使一个原子实际上从另一个原子中带走一个电子时就会出现。术语“极性”和“非极性”通常用于共价键,即极性不完全的键。为了用数值方法确定共价键的极性,使用了原子电负性之间的差异。
键极性通常根据两个键原子之间电负性的不同粗略地分为三组。根据鲍林标度:
- 非极性键通常在两个原子之间的电负性差小于0.5时出现
- 当两个原子之间的电负性差大约在0.5和2.0之间时,通常会出现极性键
- 离子键通常在两个原子之间的电负性差大于2.0时出现
鲍林把这种分类方案建立在一个键的部分离子特性上,这是两个键原子之间电负性差异的近似函数。他估计1.7的差异对应于50%的离子特性,因此更大的差异对应于主要是离子的键。[3]
作为量子力学描述,鲍林提出极性分子AB的波函数是共价和离子分子波函数的线性组合:ψ = aψ(A:B) + bψ(A+B)。共价和离子特征的数量取决于平方系数a2 和b2的值。[4]
2 分子极性编辑
虽然分子可以被描述为“极性共价”、“非极性共价”或“离子”,但这通常是一个相对的术语,一个分子只是比另一个分子更极性或更非极性。然而,这些分子的典型特性如下。
分子由不同原子分子轨道之间的一个或多个化学键组成。分子可以是极性的,或者是由于如上所述电负性的差异导致的极性键,或者是非极性共价键和称为全分子轨道的非键电子对的不对称排列的结果。
2.1 极性分子
极性分子由于极性键不对称排列的相反电荷(即具有部分正电荷和部分负电荷)而具有净偶极。水(H2O)是极性分子的一个例子,因为它一面带轻微正电荷,另一面带轻微负电荷。偶极不会抵消,从而产生净偶极。由于水分子本身的极性,极性分子通常能够溶解在水中。其他例子包括糖(如蔗糖),它有许多极性氧-氢基团,总体上是高极性的。
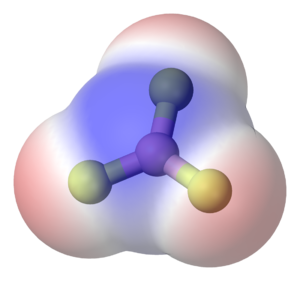
如果分子的键偶极矩不抵消,分子就是极性的。例如,水分子(H2O)在弯曲(非线性)几何形状中包含两个极性氧氢键。键偶极矩不抵消,因此分子形成一个分子偶极矩,其负极在氧原子上,正极在两个氢原子中间。在图中,每个键将带负电荷的中心氧原子(红色)连接到带正电荷的氢原子(蓝色)。
氟化氢分子由于极性共价键而具有极性——在共价键中,电子被移向电负性更强的氟原子。氨、NH3、分子这三个氮氢键只有轻微的极性(朝向电负性更强的氮原子)。分子在轨道上有两个孤电子,指向近似四面体的第四个顶点。这个轨道不参与共价键合;它富含电子,在整个氨分子中产生强大的偶极。
在臭氧(O3)分子中,两个氧氧键是非极性的(同一元素的原子之间没有电负性差异)。然而,其他电子的分布是不均匀的——因为中心原子必须与两个其他原子共享电子,但是每个外部原子只能与一个其他原子共享电子,所以中心原子比其他原子更缺乏电子(中心原子的形式电荷为+1,而外部原子的形式电荷各为-1/2)。由于分子具有弯曲的几何形状,其结果是整个臭氧分子都是偶极。
当比较具有相似摩尔质量的极性和非极性分子时,极性分子通常具有更高的沸点,因为极性分子之间的偶极-偶极相互作用导致更强的分子间吸引力。极性相互作用的一种常见形式是氢键,也称为氢键。例如,与熔点为-161℃的非极性甲烷相比,水形成氢键,摩尔质量为-18,沸点为+100℃。
2.2 非极性分子
当双原子分子的两个原子之间有相等的电子共享时,或者由于更复杂分子中极性键的对称排列,分子可以是非极性的。例如,三氟化硼(BF3)在120处具有三个极性键的三角平面排列。这导致分子中没有总偶极。
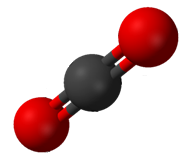
二氧化碳(CO2)有两个极性碳氧键,但CO2的几何形状是线性的,因此这两个键偶极矩相互抵消,没有净分子偶极矩;分子是非极性的。
家用非极性化合物的例子包括脂肪、油和石油/汽油。大多数非极性分子在室温下不溶于水(疏水)。许多非极性有机溶剂,如松节油,能够溶解非极性物质。
在甲烷分子中,四个碳氢键围绕碳原子四面体排列。每个键都有极性(尽管不是很强)。这些键对称排列,所以分子中没有总偶极。由于电负性相等,双原子氧分子(O2)在共价键中没有极性,因此分子中没有极性。
2.3 两亲分子
一端带有极性基团而另一端带有非极性基团的大分子被描述为两亲分子。它们是良好的表面活性剂,有助于水和脂肪形成稳定的乳液或混合物。表面活性剂通过在液-液界面吸附来降低油和水之间的界面张力。
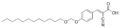
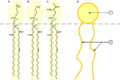
这种两亲分子在右侧有几个极性基团(亲水的),在左侧有一个长的非极性链(亲脂的)。这使它具有表面活性。
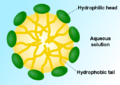
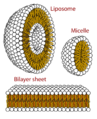
胶束——表面活性剂分子的亲脂性末端溶解在油中,而亲水性带电末端留在水相外面,屏蔽其余的疏水胶束。这样,小油滴变成水溶性的。
磷脂是具有重要生物功能的有效天然表面活性剂。
磷脂能形成的结构的横截面图。它们能形成胶束,对细胞膜的形成至关重要。
3 预测分子极性编辑
| 公式 | 描述 | 例子 | 名称 | |
|---|---|---|---|---|
| 极性的 | AB | 线性分子 | CO | 一氧化碳 |
| HAx | 只有一个氢的分子 | HF | 氟化氢 | |
| AxOH | 一端带有羟基的分子 | C2H5OH | 乙醇 | |
| OxAy | 一端带有氧的分子 | H2O | 水 | |
| NxAy | 一端含氮的分子 | NH3 | 氨 | |
| 非极性的 | A2 | 同一元素的双原子分子 | O2 | 双氧 |
| CxAy | 大多数碳化合物 | CO2 | 二氧化碳 |
确定点群是预测分子极性的有用方法。一般来说,如果分子的单个键偶极矩相互抵消,分子就不会有偶极矩。这是因为偶极矩是具有大小和方向的欧几里德向量,两个相等的向量彼此相对会抵消。
任何具有反转中心(“I”)或水平镜面(“σh”)的分子都不会拥有偶极矩。同样,一个分子有一个以上的Cn轴将不会拥有偶极矩,因为偶极矩不能位于一个以上的维度。作为该约束的结果,所有具有D对称性的分子(schnflies符号)将因此不具有偶极矩,因为根据定义,D点群具有两个或多个Cn轴。
由于C1、铯、碳∨氢Cn和Cnv点群没有反转中心、水平镜面或多个Cn轴,这些点群之一中的分子将具有偶极矩。
参考文献
- [1]
^Jensen, William B. (2009). "The Origin of the "Delta" Symbol for Fractional Charges". J. Chem. Educ. 86: 545. Bibcode:2009JChEd..86..545J. doi:10.1021/ed086p545..
- [2]
^Ingold, C. K.; Ingold, E. H. (1926). "The Nature of the Alternating Effect in Carbon Chains. Part V. A Discussion of Aromatic Substitution with Special Reference to Respective Roles of Polar and Nonpolar Dissociation; and a Further Study of the Relative Directive Efficiencies of Oxygen and Nitrogen". J. Chem. Soc.: 1310–1328. doi:10.1039/jr9262901310..
- [3]
^Pauling, L. (1960). The Nature of the Chemical Bond (3rd ed.). Oxford University Press. pp. 98–100. ISBN 0801403332..
- [4]
^Pauling, L. (1960). The Nature of the Chemical Bond (3rd ed.). Oxford University Press. p. 66. ISBN 0801403332..
- [5]
^Ziaei-Moayyed, Maryam; Goodman, Edward; Williams, Peter (2000-11-01). "Electrical Deflection of Polar Liquid Streams: A Misunderstood Demonstration". Journal of Chemical Education. 77 (11): 1520. Bibcode:2000JChEd..77.1520Z. doi:10.1021/ed077p1520. ISSN 0021-9584..
暂无