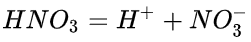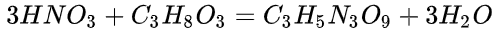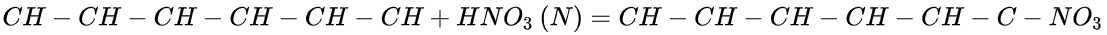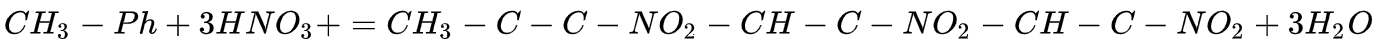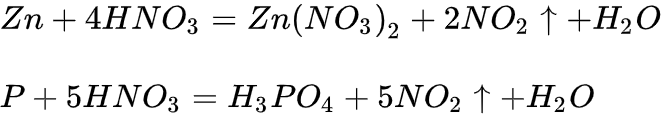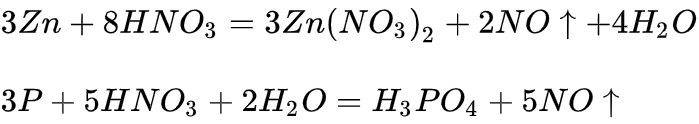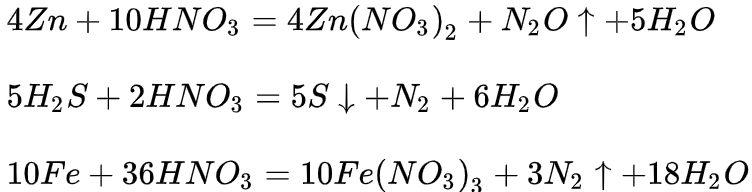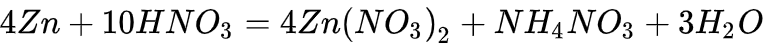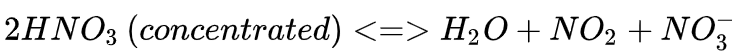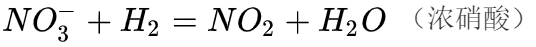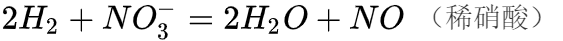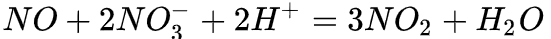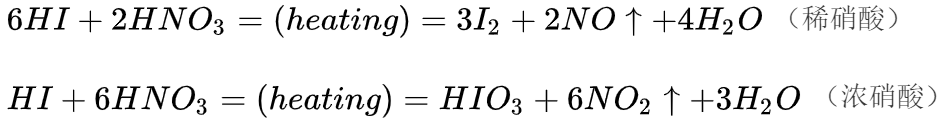硝酸
编辑硝酸是一种具有强氧化性、腐蚀性的强酸,属于一元无机强酸,是六大无机强酸之一,也是一种重要的化工原料。在工业上可用于制化肥、农药、炸药、染料、颜料、盐类等。
纯硝酸溶质是无色的,但是由于其分解成氮氧化物和水,旧的样品倾向于获得黄色铸件。大多数市售硝酸在水中的浓度为68%。当溶液中含有86%以上的HNO3时,它被称为发烟硝酸。根据存在的二氧化氮的量,发烟硝酸进一步表征为浓度高于95%的白色发烟硝酸,或浓度高于86%的红色发烟硝酸。硝酸的酸酐是五氧化二氮( )。
目录编辑
1 历史编辑
硝酸是在公元8世纪由阿拉伯炼金术士阿布·穆萨·贾比尔·伊本·哈扬(Jabir ibn Hayyan)在干馏绿矾和硝石混合物时发现的。然后在伪遗传算法中发明真理其中它是通过煅烧 硝、明矾和蓝硫酸的混合物获得的。13世纪的艾伯特大帝和雷蒙·鲁尔再次描述了它,他们通过加热硝石和粘土制备了它。Glauber 设计了一种通过用硫酸蒸馏硝酸钾来获得硝酸钾的方法。
1776年拉瓦锡表明它含有氧,1785年亨利·卡文迪许测定了它的精确组成,并表明它可以通过使一股电火花穿过潮湿的空气来合成。
1905年,挪威出现了电弧法生产硝酸的工厂,这是历史上最早的硝酸工业化尝试。
1908年,德国建成了以铂网为催化剂的日产能力3吨的硝酸厂。
1913年,合成氨问世,氨氧化法生产硝酸开始进入工业化阶段,至今依然是世界上生产硝酸的主要方法。
1935年,在中国化学家侯德榜的领导下,中国建成了第一座兼产合成氨、硝酸、硫酸和硫酸铵的联合企业-永利宁厂。
中国硝酸工业的发展
1935年,在中国化学家侯德榜的领导下,中国建成了第一座兼产合成氨、硝酸、硫酸和硫酸铵的联合企业-永利宁厂(现南京化学工业公司)。
1937年2月,永利宁厂第一次生产出优质的硝酸,但开工不到半年就遇上日本发动侵华战争。由于硝酸与国防工业密切相关,日方多次威逼永利宁厂合作,均遭侯德榜拒绝,因此工厂遭日机轰炸而停产。1945年8月日本投降后,硝酸生产逐渐恢复,但仍然处于十分落后的状态,在1949年,中国的硝酸生产企业只有两家:永利宁厂和大连化学厂(现大连化学工业公司)。
1951年5月,大连化学厂的炼焦、合成氨、硝酸和硫酸等车间的生产得到了全面的恢复,产出了硝酸产品。
1952~1958年之间,中国先后在吉林、兰州、太原等地建成了综合法硝酸装置,其中兰州化学工业公司的浓硝酸在1997年之前的几十年里一直蝉联着中国最大装置的桂冠。
1980年起,中国国内硝酸产业的发展开始加速,总产量每年以10%~15%的速度增长。特别是90年代后期,中国的硝酸工业进入蓬勃发展时期,总产量年增速达到了15%~20%。但这个时期中国硝酸生产技术仍然比较落后,早期的常压法、综合法工艺装置多为淘汰型生产线,高压法装置全部靠进口国外的二手设备。不久,山西化肥厂(现天脊集团)从国外引进了中国第一套双加压硝酸装置,从此中国的硝酸工业开始向国际先进行列迈进。
1999年,西安陕鼓动力股份有限公司成功研制出中国第一套“四合一”机组,并应用于云南云峰化学工业公司,从此加快了中国硝酸双加压工艺国产装备向国际先进水平进军的步伐。云南云峰化学工业公司作为第一个使用国产化“四合一”机组的硝酸生产企业,坚定了中国国内硝酸生产企业选择国产装备的信心。
2000年后,中国的硝酸工业进入高速发展期,年总产量以高于18%的速度快速增长,拥有各种种类、规模不等的生产厂家约60多家。
2007年11月,中国第一套在满负荷生产条件下实现副产蒸汽自足、还能富余外供蒸汽的国产化双加压法硝酸装置在新乡市永昌化工有限责任公司诞生,标志着中国自己研制的国产硝酸装置完全能够替代进口,中国国内硝酸工业摆脱了对进口装备的依赖。
2 分子结构编辑
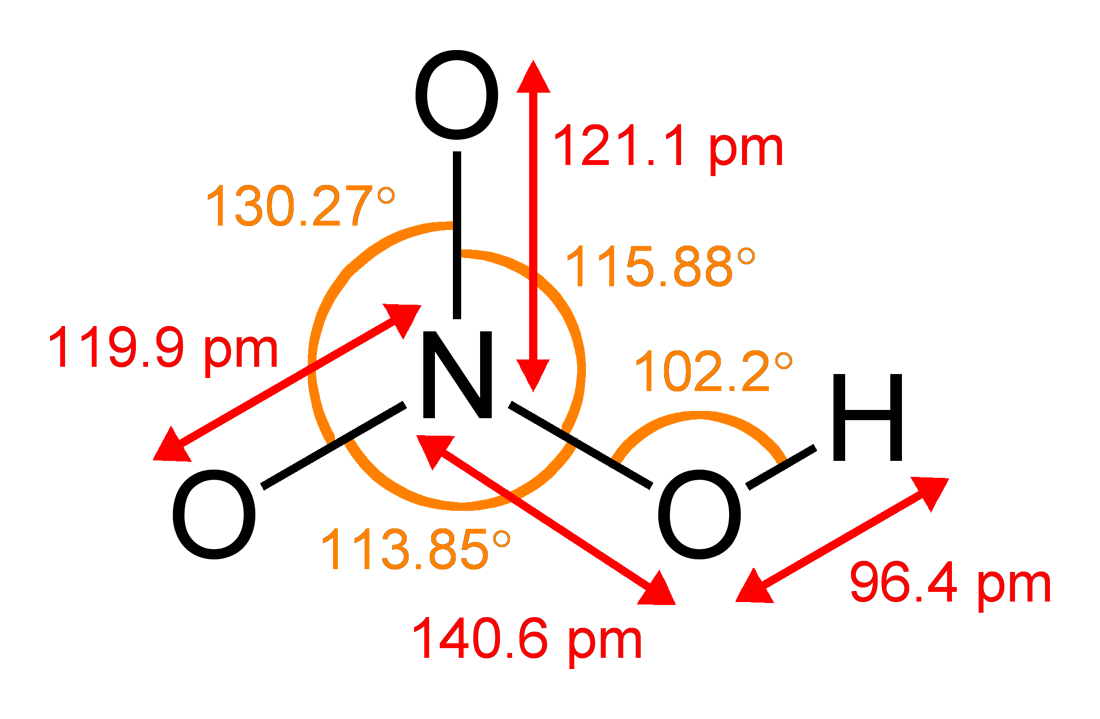
硝酸分子为平面共价分子,中心氮原子sp2杂化,未参与杂化的一个p轨道与两个端氧形成三中心四电子键。硝酸中的羟基氢与非羟化的氧原子形成分子内氢键,这是硝酸酸性和熔沸点不及硫酸、盐酸低的主要原因。两个氮氧键是等价的,相对较短,这可以用共振理论来解释。[1]
键长:
O-N:119.9pmO'-N:121.1pm
O-H:96.4pm
N-OH:140.6pm键角:
O'-N-O:130.27°
O-N-OH:113.85°O'-N-OH:115.88°N-O-H:102.2°
3 理化性质编辑
自然界中的硝酸主要由雷雨天生成的一氧化氮或微生物生命活动放出二氧化氮形成。人类活动也产生氮氧化物,全世界人为污染源每年排出的氮氧化物大约为5300万吨,这些氮氧化物也会形成硝酸。硝酸性质不稳定,因而无法在自然界长期存在,但硝酸的形成是氮循环的一环。
3.1 物理性质
纯硝酸为无色透明液体,浓硝酸为淡黄色液体(溶有二氧化氮),正常情况下为无色透明液体,有窒息性刺激气味。浓硝酸含量为68%左右,易挥发,在空气中产生白雾(与浓盐酸相同),是硝酸蒸汽(一般来说是浓硝酸分解出来的二氧化氮)与水蒸汽结合而形成的硝酸小液滴。露光能产生二氧化氮,二氧化氮重新溶解在硝酸中,从而变成棕色。有强酸性,能使羊毛织物和动物组织变成嫩黄色。能与乙醇、松节油、碳和其他有机物猛烈反应。能与水混溶。能与水形成共沸混合物。相对密度1.42g/cm³,熔点-42℃(无水),沸点122℃。对于稀硝酸, 一般我们认为浓稀之间的界线是6mol/L,市售普通试剂级硝酸浓度约为68%左右,而工业级浓硝酸浓度则为98%,通常发烟硝酸浓度约为98%。当纯酸暴露在空气中时往往会释放出白色烟雾,而溶解有二氧化氮的酸会释放出红棕色蒸汽,从而导致通称“红色发烟酸”或“发烟硝酸”——这是标况最浓的硝酸形式(STP)。
发烟硝酸
一种商业级发烟硝酸含有98%的HNO₃并且密度为1.50 g/cm³。该等级通常用于炸药行业。它不像无水酸那样易挥发,也不像无水酸那样具有腐蚀性,其浓度约为21.4 M。红色发烟硝酸或RFNA含有大量溶解的二氧化氮使溶液呈红棕色。由于溶解的二氧化氮,红色发烟硝酸的密度较低,为1.490 g/cm³。抑制发烟硝酸的产生可以通过添加0.6-0.7% 氟化氢 (HF)来制备。这种氟化物是在金属罐中为耐腐蚀性添加的,因为氟化物形成金属氟化物层来保护金属。
无水硝酸
白色发烟硝酸,纯硝酸或WFNA,非常接近无水硝酸。通过分析,它可作为99.9%硝酸使用。白色发烟硝酸的一个规格是它含有最多2%的水和最多0.5%的溶解一氧化氮。无水硝酸的密度为1.513 g/cm³并且具有大约24摩尔的浓度。无水硝酸是无色的流动液体,在42℃固化形成白色晶体。当它分解为一氧化氮和水时,它会变成黄色。沸点是83 ℃。它通常储存在顶部空间两倍的防碎玻璃琥珀瓶中,以允许压力积聚,但即使采取了这些预防措施,瓶子必须每月排气以释放压力。[2]
3.2 化学性质
不稳定性
浓硝酸不稳定,遇光或热会分解而放出二氧化氮,分解产生的二氧化氮溶于硝酸,从而使外观带有浅黄色 [6] 。但稀硝酸相对稳定。
反应方程式:4HNO₃ 光照=4NO₂↑+O₂↑+2H₂O
4HNO₃=△=4NO₂↑+O₂↑+2H₂O
酯化反应(强酸性)
硝酸可以与醇发生酯化反应生成对应的硝酸酯,在机理上,硝酸参与的酯化反应过去被认为生成了碳正离子中间体,但许多文献将机理描述为费歇尔酯化反应(Fischer esterification),即“酸脱羟基醇脱氢”与羧酸的酯化机理相同。 [3]
硝酸在水溶液中能够完全电离,产生大量氢离子:
硝酸作为氮元素的最高价(+5)水化物,具有很强的酸性,一般情况下认为硝酸的水溶液是完全电离的。硝酸可以与醇发生酯化反应,如硝化甘油的制备。
硝化甘油的制作,方程式见下:
硝化反应
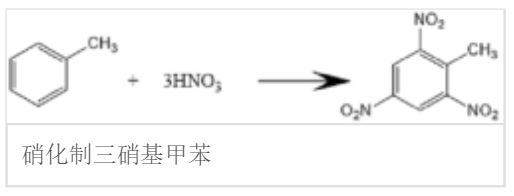
浓硝酸或发烟硝酸与脱水剂(浓硫酸、五氧化二磷)混合可作为硝化试剂对一些化合物引发硝化反应,硝化反应属于亲电取代反应(electrophilic substitution),反应中的亲电试剂为硝鎓离子,脱水剂有利于硝鎓离子的产生。[4] 最为常见的硝化反应是苯的硝化:
这种反应常被利用来生产2,4,6—三硝基甲苯(即TNT),方程式:氧化还原反应
硝酸分子中氮元素为最高价态(+5)因此硝酸具有强氧化性,其还原产物因硝酸浓度的不同而有变化。从总体上说,硝酸浓度越高,平均每分子硝酸得到的电子数越少。浓硝酸的还原产物主要为二氧化氮,稀硝酸主要为一氧化氮,更稀的硝酸可以被还原为一氧化二氮、氮气、硝酸铵等。需要指出的是,上述只是优势产物,实际上随着反应的进行,硝酸浓度逐渐降低,所有还原产物都可能出现。
硝酸有关电势图见下:(标况 E/V)
HNO₃—0.803→NO₂—1.07→HNO₂—0.983→NO—1.591→N₂O—1.77→N₂→2.27→
HNO₃—0.957→NO
HNO₃—1.11→N₂O
HNO₃—1.24→N₂
HNO₃—0.88→
典型反应
浓硝酸:
稀硝酸:
很稀硝酸:
极稀硝酸:
反应注意事项:1、纯硝酸可以发生自偶电离:
2、由于硝酸的强氧化性,所以不可以通过硝酸来制取氢气,氢离子刚从硝酸中置换出来为氢气,就被硝酸根离子氧化了。原理如:
3、硝酸的强氧化性不是来自硝酸根离子(硝酸根离子本身无氧化性),而是在酸性条件下的硝酸根离子才会有强氧化性。(例:在硝酸亚铁溶液中滴加盐酸,溶液颜色由绿变黄,滴加硫氰化钾溶液,溶液变为血红色。证明亚铁离子被再一次氧化成铁离子。)
4、硝酸的氧化性与其浓度成正比。稀硝酸与金属反应生成一氧化氮,浓硝酸与金属反应同样也会生成一氧化氮,但浓硝酸的氧化性比稀硝酸强,一氧化氮刚反应出来,就被硝酸根离子在氢离子存在的情况下氧化成二氧化氮。方程式如下:
碘化氢与不同浓度的硝酸反应,把碘离子分别氧化成碘单质和碘酸根离子:
4 制备方法编辑
4.1 实验室制法
原料:浓硫酸,硝酸钠;
设备:烧瓶,玻璃管,烧杯,橡皮塞,加热设备(酒精灯,煤气灯等);
原理:NaN + S = △=NaHS + HN (高沸点酸制低沸点酸);
S (l)+NaN (s) => N S (s)+ HN (g) (不挥发酸制备挥发性酸);
步骤:烧瓶中加入沸石,浓硫酸和硝酸钠。置于铁架台上的铁圈上,铁圈下隔石棉网放置加热设备,烧瓶口用带有玻璃管的橡皮塞塞住,玻璃管用橡皮管相连,另一头置于有水的烧杯中。注意事项:加热硫酸需要用沸石以防止硫酸暴沸,玻璃管连接处要尽量挨在一起,防止反应生成的二氧化氮泄露,制备完成后要用碱中和瓶中物质,以免污染环境。
4.2 工业合成
氨氧化法
硝酸工业与合成氨工业密接相关,氨氧化法是工业生产中制取硝酸的主要途径,其主要流程是将氨和空气的混合气(氧:氮≈2:1)通入灼热(760~840℃)的铂铑合金网,在合金网的催化下,氨被氧化成一氧化氮(NO)。生成的一氧化氮利用反应后残余的氧气继续氧化为二氧化氮,随后将二氧化氮通入水中制取硝酸(原料二氧化氮是由氨氧化而得,因此硝酸工业与制氨工业密不可分)。稀硝酸、浓硝酸、发烟硝酸的制取在工艺上各不相同。
4N + 5 =催化△= 4NO+6 O
2NO + = 2N (工业上制时要不停通入氧气)
3N + O = 2HN + NO (NO循环氧化吸收)
4NO+3 +2 O=4HN
4N + +2 O=4HN
工业上也曾使用浓硫酸和硝石制硝酸,但该法耗酸量大,设备腐蚀严重,现已基本停止使用。反应过程:
NaN (s)+ S (l) NaHS (s)+ HN (g)[5]
5 应用编辑
硝酸的主要工业用途是生产肥料。硝酸用氨中和得到硝酸铵。这种应用消耗了每年生产的2600万吨硝酸中的75-80%(1987年)。其他主要应用是生产炸药、尼龙前体和特种有机化合物。[6]
5.1 有机氮化合物的前体
在有机合成、工业和其他领域中,硝基是通用的官能团。大多数苯胺衍生物是通过芳香化合物的硝化和还原制备的。硝化需要将硝酸和硫酸结合产生硝基离子,硝基离子与芳香族化合物如苯进行亲电反应。许多炸药,如 TNT ,是这样制备的。
5.2 用作氧化剂
由于硝酸同时具有氧化性和酸性,硝酸也被用来精炼金属:即先把不纯的金属氧化成硝酸盐,排除杂质后再还原。硝酸能使铁钝化而不致继续被腐蚀。还可供制氮肥、王水、硝酸盐、硝化甘油、硝化纤维素、硝基苯、苦味酸等。通过用硝酸氧化环己酮和环己醇,大规模生产尼龙,己二酸的前体。[6]
5.3 火箭推进剂
硝酸已经以各种形式用作液体燃料火箭的推进剂。这些形式包括红色发烟硝酸、白色发烟硝酸、与硫酸的混合物,以及这些形式与氟化氢抑制剂。[7]IRFNA(被抑制的红色发烟硝酸)是BOMARC 导弹的3种液体燃料成分之一。[8]
5.4 其他用途
分析纯试剂
在元素分析经过电感耦合等离子体质谱稀释硝酸(0.5-5.0%)被用作测定溶液中金属痕量的基质化合物。[9]这种测定需要超纯痕量金属级酸,因为少量金属离子会影响分析结果。它还通常用于混浊水样品、污泥样品、固体样品以及其他类型的独特样品的消化过程。
木材老化
在低浓度(大约10%)下,硝酸通常用于人工老化松树和枫树。产生的颜色是灰金色,非常像非常古老的蜡或油加工木材(木材加工)。[10]
蚀刻剂和清洁剂
硝酸的腐蚀作用被用于许多特殊应用,例如印刷制作中的蚀刻、酸洗不锈钢或电子产品中的清洗硅片。[11]硝酸、水和乙醇的溶液用于蚀刻金属以揭示微观结构。硝酸可以与盐酸结合使用,也可以单独用于高端显微镜中清洁玻璃盖片和载玻片。[12]它能够被用于在给银镜镀银之前进行玻璃清洁。[13]浓硝酸可将苯、蒽、萘和其他芳香族化合物硝化制取有机原料,如硝酸和硫酸的混酸,工业上常用由30%与苯反应,生成硝基苯,再加氢生成苯胺,它是合成染料、医药、农药的中间体。 制造草酸:以农作物废料如玉米蕊、甘蔗渣、谷壳、花生壳等为原料与硝酸反应,制取草酸,硝酸与丙烯或乙烯、乙二醇作用也可制取草酸。硝酸还可用作生物碱如LSD 的斑点试验,根据生物碱给出各种颜色。[14]
6 安全编辑
6.1 危险性
与硝酸蒸气接触有很大危险性。硝酸溶液及硝酸蒸气对皮肤和粘膜有强刺激和腐蚀作用。浓硝酸烟雾可释放出五氧化二氮(硝酐)遇水蒸气形成酸雾,可迅速分解而形成二氧化氮。浓硝酸加热时产生硝酸蒸气,也可分解产生二氧化氮,吸入后可引起急性氮氧化物中毒。口服硝酸可引起腐蚀性口腔炎和胃肠炎,可出现休克或肾功能衰竭等。人在低于12ppm(30mg/m³)左右时未见明显的损害。国外报道3例吸入硝酸烟雾后短时间内无呼吸道症状,4-6h后呼吸困难,入院后均有发绀及口、鼻流出泡沫液体。机械通气及100%氧气吸入,在24h内死亡。经尸检,肺组织免疫组织学分析及电镜检查表明细胞损伤可能由于二氧化氮的水合作用产生自由基所引起的,此种时间依赖的作用可能是迟发性肺损伤症状的部分原因。
危险性类别:酸性腐蚀品、氧化剂、易制爆、强腐蚀(含量高于70%)/氧化剂(含量不超过70%)。
侵入途径:吸入、食入。
健康危害:吸入硝酸气雾产生呼吸道刺激作用,可引起急性肺水肿。口服引起腹部剧痛,严重者可有胃穿孔、腹膜炎、喉痉挛、肾损害、休克以及窒息。眼和皮肤接触引起灼伤。 慢性影响:长期接触可引起牙齿酸蚀症。
环境危害:对环境有害。
燃爆危险:助燃、与可燃物混合会发生爆炸。
6.2 急救措施
皮肤接触:立即脱去污染的衣物,用大量流动清水冲洗20~30分钟。如有不适感,就医。
眼睛接触:立即提起眼睑,用大量流动清水或生理盐水彻底冲洗10~15分钟。如有不适感,就医。
吸入:迅速脱离现场至空气新鲜处。保持呼吸道通畅。如呼吸困难,输入氧气。呼吸、心跳停止,立即进行心肺复苏术。就医。
食入:用水漱口,饮用牛奶或蛋清。就医。
6.3 泄漏应急措施
应急处理:根据液体流动和蒸气扩散的影响区域划定警戒区,无关人员从侧风、上风向撤离至安全区。建议应急处理人员戴正压自给式呼吸器,穿防酸碱服。作业时使用的所有设备应接地。穿上适当的防护服前严禁接触破裂的容器和泄漏物。尽可能切断泄漏源,防止泄漏物进入下水道、地下室或密闭性空间。喷雾状水抑制蒸气或改变蒸气云流向,避免水流接触泄漏物。勿使水进入包装容器内。小量泄漏:用干燥的砂土或其它不燃材料覆盖泄漏物。大量泄漏:构筑围堤或挖坑收容,用农用石灰(CaO)、碎石灰石(CaC )或碳酸氢钠(NaHC )中和。用抗溶性泡沫覆盖,减少蒸发。用耐腐蚀泵转移至槽车或专用收集器内。[15]
参考文献
- [1]
^宋天佑.无机化学 下册.高等教育出版社,2010,
- [2]
^徐刘平.《工业化学》.高级技工出版社,2010,
- [3]
^张万霞.硝酸与金属反应面面观.理科考试研究(高中版),2015,
- [4]
^曾昭琼主编.《有机化学》上册.高等教育出版社,2008,
- [5]
^大连理工大学无机化学教研室.《无机化学(第五版)》.高等教育出版社,2008,
- [6]
^Thiemann, Michael; Scheibler, Erich; Wiegand, Karl Wilhelm (2000). "Nitric Acid, Nitrous Acid, and Nitrogen Oxides". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a17_293. ISBN 978-3527306732..
- [7]
^Clark, John D (1972). Ignition!. Rutgers University Press. ISBN 978-0-8135-0725-5..
- [8]
^"BOMARC Summary". BILLONY.COM. Retrieved 2009-05-28..
- [9]
^Clesceri, Lenore S.; Greenberg, Arnold E.; Eaton, Andrew D., eds. (1998). Standard methods for the examination of water and wastewater (20th ed.). American Public Health Association, American Water Works Association, Water Environment Federation. ISBN 978-0-87553-235-6.[页码请求].
- [10]
^Jewitt, Jeff (1997). Hand-applied finishes. Taunton Press. ISBN 978-1-56158-154-2. Retrieved 2009-05-28..
- [11]
^村冈久史(1995)“硅片清洗流体与HNO”3、氢氟酸、盐酸、表面活性剂和水”美国专利 5,635,463.
- [12]
^Fischer, A. H.; Jacobson, K. A.; Rose, J.; Zeller, R. (1 May 2008). "Preparation of Slides and Coverslips for Microscopy". Cold Spring Harbor Protocols. 2008 (6): pdb.prot4988. doi:10.1101/pdb.prot4988. PMID 21356831..
- [13]
^Curtis, Heber D. (February 1911). "Methods of Silvering Mirrors". Publications of the Astronomical Society of the Pacific. 23: 13. doi:10.1086/122040..
- [14]
^O’Neal, Carol L; Crouch, Dennis J; Fatah, Alim A (April 2000). "Validation of twelve chemical spot tests for the detection of drugs of abuse". Forensic Science International. 109 (3): 189–201. doi:10.1016/S0379-0738(99)00235-2. PMID 10725655..
- [15]
^MSDS官网.硝酸安全技术说明书.未知,未知,
暂无