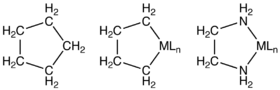
金属杂环
编辑1 命名法编辑
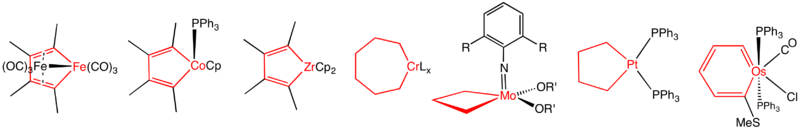
许多环中含有金属的化合物是已知的,例如螯合环。通常这样的化合物不被归类为金属杂环,但并没有严格遵循命名惯例。在配位化学和超分子化学领域,例子包括金属冠醚、金属穴醚、金属螺旋状物和分子轮。
2 金属杂环的种类编辑
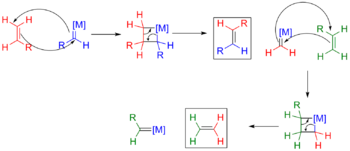
金属-烯烃配合物可以被视为最小的金属杂环,但它们通常不被归类为金属杂环。在杜瓦-查特-邓肯森(Dewar-Chatt-Duncanson )模型中,M(η2-烯烃)中心的一个共振结构是金属杂环丙烷。
2.1 金属杂环丁烷
金属杂环丁烷的母体分子式为LnM(CH2)3,其中L是与M相连的配体。一个稳定的实例是(PPh3)2Pt(CH2)3。第一个实例是通过将环丙烷氧化加成到铂上制备的。
金属杂环丁烷中间体参与了烯烃复分解、乙烯的低聚及二聚反应。在烯烃复分解反应中,肖万机理提出了烯烃对亲电金属卡宾催化剂的进攻。[5][6][7]这项工作有助于验证肖万烯烃复分解机理。
2.2 金属杂环戊二烯和金属苯
金属杂环戊二稀的母体分子式为LnM(CH)4。大多数是由两个炔烃在低价金属中心如钴(I)和锆(II)的衍生物上偶联而成的。后过渡金属衍生物(钴、镍)是金属催化炔烃三聚成芳烃的中间体。前过渡金属衍生物(钛、锆)则按化学计量使用。[3]例如,锆杂环戊二烯Cp2ZrC4Me4是C4Me42-的有用载体。[3]一些最古老的金属杂环是铁杂环,它们是分子式为Fe2(C2R4)(CO)6的两金属原子杂的环戊二烯配合物。它们来自炔烃偶联以及噻吩脱硫。[4]
金属苯的母体分子式为LnM(CH)5。它们可以被视为一个CH中心被过渡金属配合物取代的苯的衍生物。[5]
2.3 金属环丙烯
金属杂环戊烷的母体分子式为LnM(CH2)4。这些化合物是金属催化乙烯二聚、三聚和四聚反应的中间体,其相应生成1-丁烯、1-己烯和1-辛烯。[6]金属杂环戊烷被提出是非均相烯烃复分解催化剂(乙烯和金属氧化物)的过程中间体。金属杂环戊烷中间体被认为是先异构化成金属杂环丁烷,然后消除丙烯从而得到亚烷基。[7]
参考文献
- [1]
^Elschenbroich, C. ”Organometallics” (2006) Wiley-VCH: Weinheim. ISBN 978-3-527-29390-2.
- [2]
^Jolly, William L. (1989). Modern Inorganic Chemistry (third ed.). McCraw-Hill. ISBN 0-07-032760-2..
- [3]
^Rosenthal, Uwe; Burlakov, Vladimir V.; Bach, Marc A.; Beweries, Torsten (2007). "Five-membered metallacycles of titanium and zirconium – attractive compounds for organometallic chemistry and catalysis". Chem. Soc. Rev. 36: 719–728. doi:10.1039/b605734a..
- [4]
^G. Dettlaf, E. Weiss "Kristallstruktur, 1H-NMR- und Massenspektrum von Tricarbonylferracyclopentadien-Tricarbonyleisen, C4H4Fe2(CO)6 Journal of Organometallic Chemistry 1976, vol. 108, pp. 213-223..
- [5]
^Bleeke, J.R. (2001). "Metallabenzenes". Chem. Rev. 101 (5): 1205–27. doi:10.1021/cr990337n. PMID 11710218..
- [6]
^Dixon, John T.; Green, Mike J.; Hess, Fiona M.; Morgan, David H. (2004). "Advances in selective ethylene trimerisation – a critical overview". Journal of Organometallic Chemistry. 689: 3641–3668. doi:10.1016/j.jorganchem.2004.06.008..
- [7]
^Schrock, R. R.; Coperet, C. (2017). "Formation of High-Oxidation-State Metal-Carbon Double Bonds". Organometallics. 36: 1884–1892. doi:10.1021/acs.organomet.6b00825.CS1 maint: Uses authors parameter (link).
- [8]
^Bennett, M. A.; Milner, D. L. (1969). "Chlorotris(triphenylphosphine)iridium(I) and related complexes. Oxidative addition reactions and hydrogen abstraction from the coordinated ligand". J. Am. Chem. Soc. 91: 6983–6994. doi:10.1021/ja01053a016..
- [9]
^Cope, A. C.; Siekman, R. W. (1965). "Formation of Covalent Bonds from Platinum or Palladium to Carbon by Direct Substitution". J. Am. Chem. Soc. 87: 3272–3273. doi:10.1021/ja01092a063..
- [10]
^Shaw, B. L. (1975). "Formation of large rings, internal metalation reactions, and internal entropy effects". J. Am. Chem. Soc. 97: 3856–3857. doi:10.1021/ja00846a072..
- [11]
^Chatt, J.; Davidson, J. M. (1965). "The tautomerism of arene and ditertiary phosphine complexes of ruthenium(0), and the preparation of new types of hydrido-complexes of ruthenium(II)". J. Chem. Soc.: 843. doi:10.1039/JR9650000843..
暂无