软体动物门
编辑软体动物门是无脊椎动物的第二大门。成员被称为软体动物(molluscs 或 mollusks )。大约85,000种现存的软体动物被确认。[1]化石物种的数量估计在60,000到100,000种之间。未被确定物种的比例非常高。许多分类群仍然研究得很少。[2]
软体动物是最大的海洋生物门类,约占所有海洋生物的23%。许多软体动物也生活在淡水和陆地栖息地。它们高度多样化,不仅体现在大小和原子结构上,而且体现在行为和栖息地上。该门通常分为8或9个分类类别,其中两个已完全灭绝。头足类软体动物,如鱿鱼、乌贼和章鱼,是所有无脊椎动物中神经系统最发达的——巨型鱿鱼或巨型乌贼是已知最大的无脊椎动物物种。腹足类(蜗牛和蛞蝓)是迄今为止数量最多的软体动物,占总分类物种的80%。
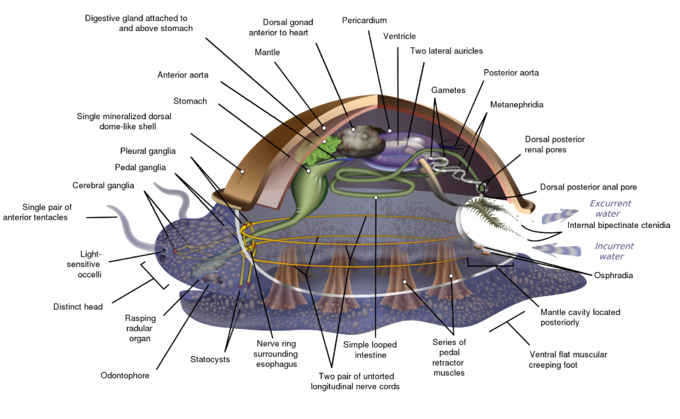
定义现代软体动物的三个最普遍的特征是具有用于呼吸和排泄的显著外套空腔、齿舌(除了双壳类)的存在和神经系统的结构。除了这些常见的元素,软体动物表现出巨大的形态多样性,所以许多教科书把它们的描述建立在“假设的祖先软体动物”的基础上(见下图)。它的顶部只有一个“帽贝样”外壳,由蛋白质和用碳酸钙强化的甲壳质组成,由覆盖整个上表面的外套膜分泌。动物的下侧由一只肌肉发达的“脚”组成。虽然软体动物是体腔动物,体腔往往很小。主体腔是血液循环通过的体腔;因此,它们的循环系统主要是开放的。“广义”软体动物的进食系统包括一个锉的的“舌头”、舌管和在一个复杂的消化系统中,粘液和微小的、由肌肉提供动力的“毛发”(称为纤毛)发挥着各种重要作用。广义软体动物有两对神经索,或双壳类有三对。在有大脑的物种中,大脑环绕食道。大多数软体动物都有眼睛,并且都有传感器来探测化学物质、振动和触摸。最简单的软体动物生殖系统依赖于外部受精,但会发生更复杂的变化。它们都产生卵,从中可能出现担轮幼虫、更复杂的幼虫或微型成虫。体腔缩小了。它们有开放的循环系统和类似肾脏的排泄器官。
在5.41亿到4.854亿年前的寒武纪时期,有很好的证据证明腹足类动物、头足类动物和双壳类动物的出现。然而,软体动物从原始的冠轮动物进化而来,以及它们向众所周知的生物和化石形态多样化的演化历史,仍然是科学家们激烈争论的话题。
软体动物过去是,现在仍然是解剖学上现代人类的重要食物来源。然而,在特定条件下,毒素可能在某些软体动物体内积累,因此存在食物中毒的风险,许多国家都有减少这种风险的法规。几个世纪以来,软体动物也是重要奢侈品的来源,尤其是珍珠、珍珠之母、泰伦紫色染料和海藻纤维。在一些前工业化社会,它们的壳也被用作货币。
软体动物物种也可能对人类活动造成危害或成为害虫。蓝环章鱼的咬伤通常是致命的,而阿波罗章鱼的咬伤会引起持续一个月以上的炎症。几种大型热带锥壳动物的刺也能杀死人,但是它们复杂而容易制造的毒液已经成为神经学研究的重要工具。血吸虫病通过水蜗牛宿主传播给人类,并影响大约2亿人。蜗牛和蛞蝓也可能是严重的农业害虫,一些蜗牛物种被意外或故意引入新的环境已经严重破坏了一些生态系统。
目录编辑
1 词源编辑
2 定义编辑
软体动物身体结构最普遍的特征是有一个用于呼吸和排泄的重要外套空腔,以及神经系统的组织。许多有钙质外壳。[7]
软体动物已经发展出如此多样的身体结构,很难找到适用于所有现代群体的共源性状(特征)。软体动物最普遍的特征是无节段且两侧对称。以下是所有现代软体动物的特征:
- 体壁的背侧部分是一个能分泌钙质骨针、板或壳的外套膜。它与身体重叠,有足够的空间形成一个外套空腔。
- 肛门和生殖器通向外套腔。
- 有两对主神经索。
教科书中常见的其他特征,也有明显的例外:
| 这类软体动物是否有特征性 | |||||||
| 假定普遍软体动物的特征 | 无板纲 | 多板纲 | 单板纲 | 腹足纲 | 头足纲[8] | 双壳纲 | 掘足纲 |
|---|---|---|---|---|---|---|---|
| 齿舌,一种带有几丁质物质的锉的“舌头 | 20%的新月贝类缺失 | 有 | 有 | 有 | 有 | 不 | 在内部,不能延伸到身体之外 |
| 宽而肌肉发达的“脚” | 衰退或缺失 | 有 | 有 | 有 | 进化成武器 | 有 | 小,只在“前”端 |
| 内脏器官的背部集中 | 不明显 | 有 | 有 | 有 | 有 | 有 | 有 |
| 大型消化盲肠 | 有些甲壳纲动物没有盲肠 | 有 | 有 | 有 | 有 | 有 | 有 |
| 大型复杂后肾管(“肾”) | 无 | 有 | 有 | 有 | 有 | 有 | 小,简单 |
| 一个或多个(贝)壳瓣/外壳 | 有原始形式;无现代形式 | 有 | 有 | 蜗牛有;蛞蝓大部分有(内部残留) | 章鱼无;乌贼,鹦鹉螺,鱿鱼有 | 有 | 有 |
| 舌突起 | 有 | 有 | 有 | 有 | 有 | 无 | 有 |
3 多样性编辑
已知的现存软体动物的种类估计从50000种到最多120000种不等。[9]1969年,大卫·尼科尔估计活软体动物物种总数可能为107,000种,其中淡水腹足动物约12,000种,陆地动物约35,000种。双壳类约占总数的14%,其他五类不到现存软体动物的2%。[10] 2009年,查普曼估计现存的物种数量为85,000种。[9] 哈斯普鲁纳尔在2001年估计约有93,000种已命名物种, 其中包括所有已命名海洋生物的23%。[11] 软体动物在活体动物物种数量上仅次于节肢动物——远远落后于节肢动物1113000种,但远远超过脊索动物52000种。[12] 据估计,现存物种总数约为20万种,[9][13] 和70,000种化石物种,[14] 曾经存在的软体动物物种的总数无论是否保存,肯定比今天活着的数量多很多倍。[14]
软体动物门比任何其他动物门都有更多样的形式。它们包括蜗牛、蛞蝓和其他腹足动物;蛤类和其他双壳类;鱿鱼和其他头足类动物;和其他不太为人知但同样与众不同的亚群。大多数物种仍然生活在海洋中,从海岸到深海地带,但有些物种构成了淡水动物和陆地生态系统的重要组成部分。软体动物在热带和温带地区极其多样,但在所有纬度都能找到。[15] 在所有已知软体动物物种中,大约80%是腹足类动物。 头足类动物如鱿鱼、乌贼和章鱼是所有无脊椎动物中神经系统最发达的。[15] 到目前为止,人们还没有观察到生活在成年形态中的大王乌贼,[16]它是世界上最大的无脊椎动物之一,但最近发现的一条长10米(33英尺)、重500公斤(1100磅)的大王乌贼标本,可能已经超过了它。[17]
淡水和陆地软体动物似乎特别容易灭绝。对非海洋软体动物数量的估计差异很大,部分原因是许多地区没有被彻底调查。还缺少能够将任何一个地区的所有动物按物种进行识别的专家。然而,在2004年,自然保护联盟的濒危物种红色名录包括了近2000种濒临灭绝的非海洋软体动物。相比之下,绝大多数软体动物是海洋动物,但其中只有41种出现在2004年的红色名单上。自1500年以来,记录在案的物种灭绝中约有42%是软体动物,几乎完全由非海洋物种组成。[18]
4 假想的软体动物祖先编辑
由于软体动物的解剖结构差异很大,许多教科书以描述所谓的档案软体动物、假设的广义软体动物或假设的祖先软体动物(HAM)作为软体动物解剖的开始,以说明软体动物门中最常见的特征。描述在视觉上与现代单板纲动物非常相似。[19][19][19][19]
广义软体动物是双侧对称的,并且在顶部有一个单一的“帽贝样”壳。外壳由覆盖上表面的覆盖物分泌。底面由一只肌肉发达的“脚”组成。[19]内脏团块,或内脏层,是软体动物柔软的、非肌肉代谢区域。它包含身体器官。[20]
4.1 外套膜和外套腔
外套腔是外套膜中的一个褶皱,它封闭了大量的空间。它有表皮做衬里,根据栖息地的不同,暴露在海洋、淡水或空气中。在最早的软体动物中,空腔位于后部,但现在它的位置因群体而异。肛门、进入“通道”的一对嗅检器化学传感器)、最后面的一对鳃以及肾原体(肾)和性腺(生殖器官)的出口都在外套腔中。[19] 双壳类软体动物整个柔软的身体位于扩大的外套腔内。[20]
4.2 壳
外套膜边缘分泌一层壳(在许多分类群中二次缺失,如裸鳃亚目动物[20]),主要由几丁质和贝壳硬蛋白(一种碳酸钙硬化的蛋白质)组成,[19][20] 除了最外层,几乎在所有情况下都是贝壳硬蛋白(见骨膜)组成。[19]软体动物从不使用磷酸盐来构造它们坚硬的部分,[21]除了存在疑问的蛛丝类动物。[22]虽然大多数软体动物的壳主要由文石组成,但那些生有硬壳蛋的腹足动物使用方解石(有时带有文石的痕迹)来构造蛋壳。[23]
外壳由三层组成:外层(骨膜)由有机物构成,中间层由柱状方解石构成,内层由层状方解石构成,通常为珍珠质。[20]
4.3 足
底面由一只肌肉发达的足组成,在不同纲中有不同用途。[24]足带有一对充当平衡传感器的平衡器。在腹足动物中,它分泌粘液作为润滑剂来帮助运动。在只有顶壳形态的动物中,如软壳动物,足充当吸盘将动物吸附着在坚硬的表面上,垂直的肌肉将壳夹在上面;在其他软体动物中,垂直肌肉将足和其他暴露在外的柔软部分拉入壳中[19],双壳类动物的足部适应于在沉积物中挖洞;[24]头足类动物的足部适应于喷气推进。[24]触须和手臂来自足。[25]
4.4 循环系统
大多数软体动物的循环系统主要是开放的。虽然软体动物是体腔动物,但它们的体腔缩小到相当小的空间,包围着心脏和性腺。主体腔是血液和体腔液循环通过的血腔,它包裹着大多数其他内部器官。这些血腔充当了一个有效的流体静力骨架。[20]这些软体动物的血液含有呼吸色素血蓝蛋白作为氧载体。心脏由一对或多对心房组成,心房从鳃接收含氧血液并将其泵入心室,心室将其泵入主动脉(大动脉),主动脉相当短并通向血腔。[19] 心脏的心房也是排泄系统的一部分,通过过滤血液中的废物,并将其作为尿液排入体腔。体腔后部的一对肾原体(“小肾”)从尿液中提取任何可重复利用的物质,并将额外的废物倾倒在尿液中,然后通过排泄管将其排出外套腔。[19]
上述情况的例外是软体动物中的扁蜷螺科或羊角螺,它们是呼吸空气的蜗牛,使用铁基血红蛋白而不是铜基血蓝蛋白,通过它们的血液来运送氧气。
4.5 呼吸系统
大多数软体动物只有一对鳃,甚至只有一个单一的鳃。一般来说,鳃在形状上很像羽毛,尽管有些物种的鳃只有一边有细丝。它们分隔外套腔,所以水在底部附近进入,在顶部附近流出。它们的细丝有三种纤毛,一种驱使水流通过外套腔,另两种帮助保持鳃的清洁。如果嗅检器探测到有毒化学物质或者可能是沉积物进入外套腔,鳃的纤毛可能会停止跳动,直到不受欢迎的入侵停止。每个鳃都有一条连接到体腔的血管和一条连接到心脏的血管。[19]
4.6 进食、消化和排泄
软体动物家族的成员利用细胞内消化来发挥作用。大多数软体动物都有肌肉发达的口,口中长着“舌头”,舌头上长着许多排几丁质的牙齿,当它们磨损时,这些牙齿会从后面被替换掉。齿舌的主要功能是从岩石上刮下细菌和藻类,并与牙本质(软骨支撑器官)有关。[20]齿舌是软体动物独有的,在任何其他动物中都没有。
软体动物的嘴也含有分泌粘液的腺体,食物会附着在黏液上。鞭毛(微小的“毛发”)将粘液推向胃,所以粘液形成一条被称为“食物串”的长串。[19]
在胃的锥形后端,略微伸入后肠的是前柱式构造,这是一个粪便和粘液的后向锥体,它被更多的纤毛旋转,因此它就像一个线轴,将粘液串缠绕在自己身上。在粘液串到达前柱式构造之前,胃的酸性使粘液不那么粘稠,并释放出颗粒。[19]
这些颗粒被另一组纤毛分类,纤毛将较小的颗粒(主要是矿物质)送到前柱式构造,最终排出体外,而较大的颗粒(主要是食物)被送到胃的盲肠(一个没有其他出口的囊)消化。消化过程绝非完美。[19]
后肠入口处的圆形肌肉周期性地挤压并排出一部分前柱式构造,防止前柱式构造变得过大。肛门位于外套腔的一部分,被鳃产生的水流“通道”扫过。食肉软体动物通常有更简单的消化系统。[19]
由于头部在双壳类动物中已经基本消失,嘴已经进化出了唇触须(嘴的两侧各两个),以收集粘液中的碎屑。[20]
4.7 神经系统
头足类软体动物有两对主要神经索,围绕着许多成对的神经节组织,内脏的神经索服务于内脏器官,而足部的神经索服务于足部。身体两侧对应的大多数神经节对由连合部(相对较大的神经束)连接。肠道上方的神经节是大脑的、胸膜的和内脏的,位于食道(食道)上方。控制足部的足神经节位于食道下方,它们在食道周围的大脑和胸膜神经节的连合处与连接体环绕食道,形成食管周围的神经环或神经环。[19]
无头软体动物(即双壳类)也有这个环,但不太明显,也不太重要。双壳类动物只有三对神经节——大脑神经节、足部神经节和内脏神经节——其中内脏神经节是最大的,也是最重要的,是“思维”的主要中心。有些像扇贝这样的贝壳边缘有眼睛,眼睛与一对环状神经相连,能够辨别光线和阴影。
4.8 生殖
最简单的软体动物生殖系统依赖外部受精,但有更复杂的变异。它们都产生卵,卵中可能会出现担轮幼虫、更复杂的缘膜幼体或微型成虫。两个性腺位于体腔旁,体腔是围绕心脏的一个小腔,它们在体腔中产卵或精子。肾原体从体腔中提取配子,并将其发射到外套膜腔中。使用这种生殖系统的软体动物一生都是一种性别,并且依赖外部受精。一些软体动物使用内部受精和/或雌雄同体,具有两性功能;这两种方法都需要更复杂的生殖系统。[19]
最基本的软体动物幼虫是担轮幼虫,它是浮游生物,以漂浮的食物颗粒为食,利用围绕其“赤道”的两束纤毛将食物扫入口腔,用更多的纤毛将食物驱入胃中,用更多的纤毛通过肛门排出未消化的残余物。新组织在内部中胚层带中生长,所以随着动物的生长,顶端绒毛和肛门被进一步分开。担轮幼虫阶段之后通常是缘膜幼体阶段,在这个阶段,在这个阶段,前毛轮(最接近顶端绒毛的“赤道”纤毛带)发育成盖膜 (“面纱”),这是一对含有纤毛的裂片,幼虫在上面游动。最终,幼虫沉入海底,蜕变成成虫。虽然软体动物通常会发生变态,但头足类动物的不同之处在于,它们表现出的是直接发育:幼仔是成虫的“微型化”形态。[26]
5 生态学编辑
5.1 饲养
大多数软体动物是食草动物,以藻类或滤食动物为食。对于那些捕食场合,两种捕食策略占主导地位。有些以微小的丝状藻类为食,经常用它们的齿舌作为“耙”来清理海底的丝状物。另一些以大型“植物”为食,如海带,用它的齿舌刺穿植物表面。为了采用这种策略,植物必须足够大,以便软体动物“坐”在上面,所以较小的宏观植物不像它们较大的同类那样经常被吃掉。[27]滤食动物是一种软体动物,它们通过过滤水中的悬浮物和食物颗粒来进食,通常是通过让水从鳃上流过来进食。大多数双壳类动物是滤食性动物。
头足类动物主要是掠食性动物,在获取食物时,齿舌的作用仅次于颚和触角。单板纲新帽贝以通常的方式使用它的齿舌,但是它的食物包括原生生物。[28]囊舌亚目海蛞蝓从海藻中吸取汁液,用它们的单行齿舌刺穿细胞壁,[29]而裸鳃亚目动物和一些古腹足类动物以海绵为食,[30][31] 其他动物以水螅为食。[32]
6 分类编辑
关于软体动物门有多少个纲,众说纷纭;例如,下表显示了七个现存的纲,[33]和两个已灭绝的纲。虽然它们不太可能形成一个分支,一些更久远的研究将尾腔亚纲和或沟腹纲组合成一个纲,即无板纲。[33][33] 两个公认的“纲”仅从化石中得知。[33]
| 纲 | 主要物种 | 现存物种数量[33] | 分布 |
| 腹足纲[33] | 所有的蜗牛和蛞蝓包括鲍鱼、鲎、海螺、裸鳃亚目动物、海兔、海蝶 | 70,000 | 海洋、淡水、陆地 |
| 双壳纲[34] | 蛤蜊、牡蛎、扇贝、海胆、贻贝 | 20,000 | 海洋、淡水 |
| 多板纲[35] | 多板类动物 | 1,000 | 岩石潮汐带和海底 |
| 头足纲[35] | 鱿鱼、章鱼、乌贼、鹦鹉螺、旋乌贼目动物 | 900 | 海洋 |
| 掘足纲[36] | 掘足类动物 | 500 | 海洋6-7,000米(20-22,966英尺) |
| 无板纲[33] | 蠕虫状生物 | 320 | 海底200–3,000米(660–9,840英尺) |
| 单板纲[36] | 有帽状壳的软体动物的古老谱系 | 31 | 海底1,800-7,000米(5,900-23,000英尺);一种200米(660英尺) |
| 喙壳纲[36] | 来源于化石;可能是双壳类动物的祖先 | 已灭绝 | 海洋 |
| 太阳女神螺纲 | 来源于化石;像拉氏螺属这样的蜗牛状生物 | 已灭绝 | 海洋 |
为这些类群划分更高的类群一直是个问题。一项系统发育研究表明,多板纲与由同一新型演化的无板纲形成一个分支。[37] 此外,它表明双壳纲和腹足纲之间存在姐妹分类单元关系。竹节石纲也可能在软体动物门中。
7 进化史编辑
7.1 化石记录
有很好的证据表明腹足类动物((如螺类),头足类动物(如短棒角石属)和双壳类(贝类)在大约5亿年前寒武纪中期出现过,尽管可以说它们中的每一种可能只属于它们各自种类的茎谱系。[38]然而,软体动物从祖先群体冠轮动物总门出现以及它们多样化为众所周知的生物和化石形式的进化史,仍在激烈争论中。
关于某些埃迪卡拉纪和寒武纪早期化石是否真的是软体动物的争论不断。约5.55亿年前的金伯拉虫被一些古生物学家描述为“类软体动物”,[39][40]但如果是这样的话,其他生物学家则不愿意更加深入地研究它是“非软体动物”。[41][42][43]
关于距今约5.05亿年前的威瓦亚虫是否是软体动物,有一个更激烈的争论,其中很大一部分争论集中在它的进食装置是一种齿舌还是更类似于某些多毛类蠕虫。[41][44]尼古拉斯·巴特菲尔德反对威瓦亚虫是软体动物的观点。他写道,5.15亿至5.1亿年前的微生物化石是真正软体动物般的齿舌的碎片。[45]这似乎与软体动物祖先的齿舌被矿化的概念相矛盾。[46]
然而,太阳女神螺类动物首次出现在5.4亿年前西伯利亚和中国寒武纪早期的岩石中,[47][48]被认为是具有相当蜗牛状外壳的早期软体动物。因此带壳软体动物先于最早的三叶虫。[47]虽然大多数太阳女神螺化石只有几毫米长,但也发现了几厘米长的标本,大多数形状更像帽贝。微小的标本被认为是幼体,较大的标本是成年体。[49]
对太阳女神螺的一些分析得出结论,这些是最早的腹足动物。[50]然而,其他科学家并不相信这些早期寒武纪化石显示出现代腹足类动物扭转内脏器官、使肛门位于头部上方的明显迹象。[47][51][52]
沃尔博斯螺属,早于5.3亿年前存在的一些化石,长期以来被认为是一个头足类动物,但更详细的化石发现表明它的壳不是分泌出来的,而是由矿物二氧化硅(硅石)颗粒构成的,它不像带壳的头足类动物和现存的鹦鹉螺那样被分隔成一系列隔间。沃尔博斯螺属的分类是不确定的。[53]末寒武纪螺类化石现在被认为是最早的头足类动物化石,因为它的外壳有隔膜和体管,这是鹦鹉螺用来从它生长时空出的隔间中去除水分的一些组织,在鹦鹉螺化石外壳中也可以看到。然而,螺类和其他早期头足类动物沿着海底爬行,而不是游泳,因为它们的壳在被认为是底面的地方含有石沉积物的“压载物”,在被认为是上表面的地方有条纹和斑点。[54]除鹦鹉螺类外,所有有外壳的头足类动物都在6500万年前的白垩纪末期灭绝了。[55]然而,如今无壳的鞘形亚纲(鱿鱼、章鱼、乌贼)非常丰富。[56]
早期寒武纪化石Fordilla(壳菜蛤类)和Pojetaia(前栗蛤科)被认为是双壳类。[57][58][59][60]“外观现代”的双壳类出现在奥陶纪,即4.88亿至4.43亿年前。[61]有一种双壳类动物,即固着蛤类,在白垩纪成为主要的造礁动物,但在白垩纪-古近纪灭绝事件中灭绝。[62]尽管如此,双壳类动物仍然丰富多样。
软舌螺纲是一类已灭绝的动物,有壳和鳃盖,可能是软体动物。那些认为他们应该拥有自己的门的作者并没有评论这个门在生命树中的位置。[63]
7.2 发展史
软体动物的系统发育(进化的“家谱”)是一个有争议的话题。除了关于金伯拉虫和任何一种“哈瓦亚虫类”是软体动物还是与软体动物有密切关系的争论之外,[40][41][44][45]还出现了关于现存软体动物不同纲之间关系的争论。[42]事实上,一些传统上被归类为软体动物的族群可能需要重新定义为不同但相关的族群。[64]
软体动物通常被认为是冠轮动物的成员,[65]冠轮动物是一个由担轮幼虫和现存冠轮动物的摄食结构(称为纤毛环)组成的群体。冠轮动物的其他成员是环节动物和七个海洋动物门。[66]右图总结了2007年提出的系统发育过程。
因为家谱成员之间的关系是不确定的,所以很难确定所有软体动物从最后一个共同祖先所继承的遗传特征。[67] 例如,不确定祖先的软体动物是否是分节的(由重复单元组成)——如果是,这将表明起源于环节虫。[68] 科学家对此意见不一: 吉比特和同事们在2006年得出结论,鳃和足部收缩肌的重复是后天的发展,[69] 而在2007年,西格沃特得出结论,祖先的软体动物是分节的动物,它有一只用来爬行的足和一个矿化的“壳”。[42] 在一个特定的系谱分支中,贝壳类动物的外壳被认为是由腹足纲动物的针状体 (小刺)进化而来;但这很难与针状体的胚胎学起源相一致。[67]
软体动物的外壳似乎起源于粘液涂层,最终硬化成角质层。这是不透水的,因此迫使发展更复杂的鳃状呼吸装置。[47] 最终,角质层会矿化,[47]使用与大多数其他双壳类相同的遗传机制(植入)。[68]几乎可以肯定,第一个软体动物的壳是用矿物文石加固的。[69]
软体动物内部的进化关系也有争议,下面的图表显示了两个得到广泛支持的重组:
形态学分析倾向于恢复一个从分子分析中获得较少支持的贝类分支,[69] 尽管这些结果也会导致意想不到的副分支,例如将双壳类分散到所有其他软体动物族群中。[70]
然而,2009年的一项形态学和分子系统发育比较分析得出结论,软体动物不是单系的;特别是,掘足纲和双壳纲都是独立的单系谱系,与现存的软体动物纲无关;传统的软体动物门是多系的,只有排除掘足类和双壳类动物,才能形成单系。[64] 2010年的一项分析恢复了传统的有壳亚门和刺螺类,表明软体动物是单系动物,表明沟腹纲的现有数据有误。[71] 目前的分子数据不足以限制软体动物的系统发育,而且由于用于确定分支可信度的方法容易被高估,因此即使把过多的重点放在不同研究一致同意的领域,也是有风险的。[72] 最新研究没有消除不太可能的关系,而是增加了软体动物内部关系的新排列,甚至对贝类动物假说提出了质疑。[73]
8 人类互动编辑
千百年来,软体动物一直是人类的食物来源,也是重要的奢侈品,尤其是珍珠、珍珠母、泰伦紫色染料、海丝和化合物。在一些前工业化社会,它们的壳也被用作一种货币形式。许多种类的软体动物会咬人或蛰人,有些已经成为农业害虫。
8.1 人类的使用
软体动物,尤其是蛤蜊和贻贝等双壳类动物,至少自解剖学意义上的现代人类出现以来,一直是重要的食物来源,而这往往导致过度捕捞。[74] 其他常见的软体动物包括章鱼和鱿鱼、海螺、牡蛎和扇贝。[75]2005年,中国占全球软体动物捕获量的80%,净捕捞量近1100万吨(1100万长吨;12,000,000短吨)。在欧洲,法国仍然是行业领导者。[76] 一些国家对软体动物和其他海产品的进口和处理进行监管,主要是为了将动物体内有时会积累的毒素造成的中毒风险降至最低。[77]
大多数带壳软体动物能产珍珠,但只有双壳类和一些腹足类的珍珠有价值。[78][78] 它们的壳衬有珍珠质最好的天然珍珠是由生活在太平洋热带和亚热带水域的海洋珍珠牡蛎、珠母贝和珠母贝制成的。当一个小的外来物体卡在外套膜和外壳之间时,天然珍珠就形成了。
养殖珍珠的两种方法要么将“种子”要么将珠子植入牡蛎。“种子”方法使用淡水贻贝磨碎的壳粒,为此目的的过度捕捞已经使美国东南部的几种淡水贻贝濒临灭绝。[78] 珍珠产业在一些地区非常重要,大量资金用于监测养殖软体动物的健康。[78]
其他奢侈品和高端产品都是由软体动物制成的。西奥菲普斯说,公元前4世纪,由骨螺壳的墨汁腺制成的泰伦紫色“价值相当于银”。[79] 克里特岛上发现了大量的骨螺壳,这表明米诺斯人可能在公元前20-18世纪米诺斯中期,比泰利亚人早几个世纪,率先提取了“帝王紫”。[80][81] 海丝是一种精细、稀有且有价值的织物,由几种双壳类软体动物分泌的用于附着在海床上的长丝线制成。[82] 普罗科匹厄斯在大约公元550年的波斯战争中写道,“亚美尼亚的五个世袭总督(统治者)从罗马皇帝那里获得了他们的徽章,他们得到了海丝做的披衣(或斗篷)。显然,只有统治阶级才被允许穿这些厚衣。”[83]
软体动物的壳,包括贝类的壳,在一些前工业化社会被用作一种货币(贝壳货币)。然而,这些“货币”在许多重要方面与工业社会熟悉的标准化政府支持和控制的货币不同。一些空壳“货币”并不用于商业交易,而是主要作为重要场合的社会地位展示,如婚礼。[84] 当用于商业交易时,它们作为商品货币发挥作用,作为一种可交易商品,其价值因地而异,这往往是由于运输困难造成的,如果出现更有效的运输或“淘金热”行为,则容易受到无法挽救的通货膨胀的影响。[85]
生物指示器
双壳类软体动物被用作生物指示剂来监测淡水和海洋环境中水生环境的健康状况。它们的种群状况或结构、生理、行为或元素或受化合物的污染程度可以表明生态系统的污染状况。它们特别有用,因为它们是无柄的,所以它们代表了取样或放置它们的环境。[86] 有些水处理厂使用纽西兰泥蜗来检测来自工业农业的雌激素样污染物。
8.2 对人类有害
刺痛和咬伤
有些软体动物会叮咬,但软体动物毒液造成的死亡总数不到水母叮咬造成的死亡总数的10%。[87]
所有章鱼都有毒,[88] 但只有少数物种对人类构成重大威胁。生活在澳大利亚和新几内亚周围的蓝圈章鱼属蓝环章鱼只有在受到严重挑衅时才会咬人,[89] 但是它们的毒液杀死了25%的受害者。另一个热带物种,阿波罗章鱼“会引起严重的炎症,即使治疗得当,炎症也能持续一个多月,[90] 而红色章鱼的叮咬会导致坏死,如果不治疗,坏死会持续一个多月,即使治疗,头痛和虚弱也会持续长达一周。[91]
所有种类的芋螺都是有毒的,处理时会疼痛难忍,尽管许多种类的蜗牛太小,不会对人类造成很大的危险,而且只有少数死亡病例得到可靠的报告。它们的毒液是毒素的复杂混合物,有些作用迅速,有些作用较慢但更致命。[92][87][93] 单个芋螺毒素对受害者神经系统的影响如此精确,以至于可以成为神经病学研究的有用工具,而且它们分子的小尺寸使得合成它们变得容易。[92][94]
疾病媒介
血吸虫病(又称血吸虫病、血吸虫病或蜗牛热)是由血吸虫引起的一种疾病,是“仅次于疟疾的热带国家最具破坏性的寄生虫病”。据估计,74个国家有2亿人感染了这种疾病——仅非洲就有1亿人。”[95] 这种寄生虫有13种已知物种,其中两种感染人类。寄生虫本身不是软体动物,但所有物种都有淡水蜗牛作为中间宿主。[96]
害虫
一些软体动物物种,特别是某些蜗牛和蛞蝓,可能是严重的农作物害虫,[97] 当它们被引入新环境时,可能会使当地生态系统失衡。其中一种害虫,巨大的非洲大蜗牛,已经被引入亚洲的许多地方,以及印度洋和太平洋的许多岛屿。在20世纪90年代,这个物种到达了西印度群岛。试图通过引入捕食性蜗牛玫瑰蜗牛来控制它被证明是灾难性的,因为掠食者忽视了非洲大蜗牛,取而代之的是消灭了一些本土蜗牛物种。[98]
参考文献
- [1]
^Rosenberg, Gary (2014). "A New Critical Estimate of Named Species-Level Diversity of the Recent Mollusca". American Malacological Bulletin. 32 (2): 308–322. doi:10.4003/006.032.0204..
- [2]
^Taylor, P.D., & Lewis, D.N. (2005). Fossil invertebrates. Harvard University Press, 208 pp..
- [3]
^μαλάκια, μαλακός. Liddell, Henry George; Scott, Robert; A Greek–English Lexicon at the Perseus Project..
- [4]
^Aristotle. "Book I part 1, Book IV part 1, etc.". History of Animals..
- [5]
^Little, L.; Fowler, H.W.; Coulson, J.; Onions, C.T., eds. (1964). "Malacology". Shorter Oxford English Dictionary. Oxford University press..
- [6]
^Chisholm, Hugh, ed. (1911年). "Molluscoida" . 大英百科全书. 18 (第十一版 ed.). 剑桥大学出版社. p. 675. Check date values in: |year= (help).
- [7]
^Hogan, C. Michael. (2010). "Calcium". In Jorgensen, A.; Cleveland, C. Encyclopedia of Earth. National Council for Science and the Environment..
- [8]
^Ruppert, pp. 343–367.
- [9]
^Chapman, A.D. (2009). Numbers of Living Species in Australia and the World, 2nd edition. Australian Biological Resources Study, Canberra. Retrieved 2010-01-12. ISBN 978-0-642-56860-1 (printed); ISBN 978-0-642-56861-8 (online)..
- [10]
^Nicol, David (June 1969). "The Number of Living Species of Molluscs". Systematic Zoology. 18 (2): 251–254. doi:10.2307/2412618. JSTOR 2412618..
- [11]
^Hancock, Rebecca (2008). "Recognising research on molluscs". Australian Museum. Archived from the original on 2009-05-30. Retrieved 2009-03-09..
- [12]
^Ruppert, Front endpaper 1.
- [13]
^Ponder, Winston F. & Lindberg, David R. (2004). "Phylogeny of the Molluscs". World Congress of Malacology. Retrieved 2009-03-09..
- [14]
^Brusca, R.C. & Brusca, G.J. (2003). Invertebrates (2 ed.). Sinauer Associates. p. 702. ISBN 978-0-87893-097-5..
- [15]
^Barnes, R.S.K.; Calow, P.; Olive, P.J.W.; Golding, D.W.; Spicer, J.I. (2001). The Invertebrates, A Synthesis (3 ed.). UK: Blackwell Science..
- [16]
^Kubodera, T.; Mori, K. (December 22, 2005). "First-ever observations of a live giant squid in the wild" (PDF). Proceedings of the Royal Society B. 272 (1581): 2583–2586. doi:10.1098/rspb.2005.3158. PMC 1559985. PMID 16321779. Retrieved 2008-10-22..
- [17]
^Black, Richard (April 26, 2008). "Colossal squid out of the freezer". BBC News. Retrieved 2008-10-01..
- [18]
^Lydeard, C.; Cowie, R.; Ponder, W.F.; et al. (April 2004). "The global decline of nonmarine mollusks" (PDF). BioScience. 54 (4): 321–330. doi:10.1641/0006-3568(2004)054[0321:TGDONM]2.0.CO;2. Archived from the original on March 31, 2007.CS1 maint: Unfit url (link).
- [19]
^Ruppert, pp. 284–291.
- [20]
^Hayward, PJ (1996). Handbook of the Marine Fauna of North-West Europe. Oxford University Press. pp. 484–628. ISBN 978-0-19-854055-7..
- [21]
^Yochelson, E. L. (1975). "Discussion of early Cambrian "molluscs"" (PDF). Journal of the Geological Society. 131 (6): 661–662. Bibcode:1975JGSoc.131..661.. doi:10.1144/gsjgs.131.6.0661..
- [22]
^Cherns, L. (December 2004). "Early Palaeozoic diversification of chitons (Polyplacophora, Mollusca) based on new data from the Silurian of Gotland, Sweden". Lethaia. 37 (4): 445–456. doi:10.1080/00241160410002180..
- [23]
^Tompa, A. S. (December 1976). "A comparative study of the ultrastructure and mineralogy of calcified land snail eggs (Pulmonata: Stylommatophora)". Journal of Morphology. 150 (4): 861–887. doi:10.1002/jmor.1051500406. hdl:2027.42/50263. PMID 30257539..
- [24]
^Wilbur, Karl M.; Trueman, E.R.; Clarke, M.R., eds. (1985), The Mollusca, 11. Form and Function, New York: Academic Press, ISBN 0-12-728702-7.
- [25]
^Shigeno, S; Sasaki, T; Moritaki, T; Kasugai, T; Vecchione, M; Agata, K (Jan 2008). "Evolution of the cephalopod head complex by assembly of multiple molluscan body parts: Evidence from Nautilus embryonic development". Journal of Morphology. 269 (1): 1–17. doi:10.1002/jmor.10564. PMID 17654542..
- [26]
^Marin, F.; Luquet, G. (October 2004). "Molluscan shell proteins". Comptes Rendus Palevol. 3 (6–7): 469. doi:10.1016/j.crpv.2004.07.009..
- [27]
^Steneck, R.S.; Watling, L. (July 1982). "Feeding capabilities and limitation of herbivorous molluscs: A functional group approach". Marine Biology. 68 (3): 299–319. doi:10.1007/BF00409596..
- [28]
^Tendal O.S. (1985). "Xenophyophores (Protozoa, Sarcodina) in the diet of Neopilina galatheae (Mollusca, Monoplacophora)" (PDF). Galathea Report. 16: 95–98. Retrieved 2013-09-14..
- [29]
^Jensen, K. R. (February 1993). "Morphological adaptations and plasticity of radular teeth of the Sacoglossa (= Ascoglossa) (Mollusca: Opisthobranchia) in relation to their food plants". Biological Journal of the Linnean Society. 48 (2): 135–155. doi:10.1111/j.1095-8312.1993.tb00883.x..
- [30]
^Wägele, H. (March 1989). "Diet of some Antarctic nudibranchs (Gastropoda, Opisthobranchia, Nudibranchia)". Marine Biology. 100 (4): 439–441. doi:10.1007/BF00394819..
- [31]
^Publishers, Bentham Science (July 1999). Current Organic Chemistry. Bentham Science Publishers..
- [32]
^Lambert, W. J. (1991-10-01). "Coexistence of Hydroid Eating Nudibranchs: Do Feeding Biology and Habitat Use Matter?". Biolbull.org. Missing or empty |url= (help).
- [33]
^Ruppert, pp. 291–292.
- [34]
^Ruppert, p. 367.
- [35]
^Ruppert, pp. 292–298.
- [36]
^Ruppert, pp. 298–300.
- [37]
^Kocot, K. M.; Cannon, J. T.; Todt, C.; Citarella, M. R.; Kohn, A. B.; Meyer, A.; Santos, S. R.; Schander, C.; Moroz, L. L.; et al. (September 22, 2011). "Phylogenomics reveals deep molluscan relationships". Nature. 477 (7365): 452–456. Bibcode:2011Natur.477..452K. doi:10.1038/nature10382. PMC 4024475. PMID 21892190..
- [38]
^Budd, G. E. & Jensen, S. A critical reappraisal of the fossil record of the bilaterian phyla. Biol. Rev. 75, 253–295 (2000)..
- [39]
^Fedonkin, M.A.; Waggoner, B.M. (August 28, 1997). "The Late Precambrian fossil Kimberella is a mollusc-like bilaterian organism". Nature. 388 (6645): 868. Bibcode:1997Natur.388..868F. doi:10.1038/42242..
- [40]
^Fedonkin, M.A.; Simonetta, A.; Ivantsov, A.Y. (2007). "New data on Kimberella, the Vendian mollusc-like organism (White Sea region, Russia): palaeoecological and evolutionary implications" (PDF). Geological Society, London, Special Publications. 286 (1): 157–179. Bibcode:2007GSLSP.286..157F. doi:10.1144/SP286.12. Retrieved 2008-07-10..
- [41]
^Butterfield, N.J. (2006). "Hooking some stem-group "worms": fossil lophotrochozoans in the Burgess Shale". BioEssays. 28 (12): 1161–6. doi:10.1002/bies.20507. PMID 17120226..
- [42]
^Sigwart, J. D.; Sutton, M. D. (October 2007). "Deep molluscan phylogeny: synthesis of palaeontological and neontological data". Proceedings of the Royal Society B: Biological Sciences. 274 (1624): 2413–2419. doi:10.1098/rspb.2007.0701. PMC 2274978. PMID 17652065. For a summary, see "The Mollusca". University of California Museum of Paleontology. Retrieved 2008-10-02..
- [43]
^Budd, G. E., and S. Jensen. 2016: The origin of the animals and a “Savannah” hypothesis for early bilaterian evolution. Biological Reviews 7:Online ahead of print..
- [44]
^Caron, J.B.; Scheltema, A.; Schander, C.; Rudkin, D. (July 13, 2006). "A soft-bodied mollusc with radula from the Middle Cambrian Burgess Shale". Nature. 442 (7099): 159–163. Bibcode:2006Natur.442..159C. doi:10.1038/nature04894. hdl:1912/1404. PMID 16838013..
- [45]
^Butterfield, N.J. (May 2008). "An Early Cambrian Radula". Journal of Paleontology. 82 (3): 543–554. doi:10.1666/07-066.1..
- [46]
^Cruz, R.; Lins, U.; Farina, M. (1998). "Minerals of the radular apparatus of Falcidens sp. (Caudofoveata) and the evolutionary implications for the Phylum Mollusca". Biological Bulletin. 194 (2): 224–230. doi:10.2307/1543051. JSTOR 1543051. PMID 28570844..
- [47]
^Runnegar, B.; Pojeta Jr, J. (October 1974). "Molluscan Phylogeny: the Paleontological Viewpoint". Science. 186 (4161): 311–317. Bibcode:1974Sci...186..311R. doi:10.1126/science.186.4161.311. JSTOR 1739764. PMID 17839855..
- [48]
^Steiner, M.; Li, G.; Qian, Y.; Zhu, M.; Erdtmann, B.D. (2007). "Neoproterozoic to Early Cambrian small shelly fossil assemblages and a revised biostratigraphic correlation of the Yangtze Platform (China)". Palaeogeography, Palaeoclimatology, Palaeoecology. 254 (1–2): 67. Bibcode:2007PPP...254...67S. doi:10.1016/j.palaeo.2007.03.046..
- [49]
^Mus, M.M.; Palacios, T.; Jensen, S. (2008). "Size of the earliest mollusks: Did small helcionellids grow to become large adults?". Geology. 36 (2): 175. Bibcode:2008Geo....36..175M. doi:10.1130/G24218A.1..
- [50]
^Landing, E.; Geyer, G.; Bartowski, K. E. (2002). "Latest Early Cambrian Small Shelly Fossils, Trilobites, and Hatch Hill Dysaerobic Interval on the Quebec Continental Slope". Journal of Paleontology. 76 (2): 287–305. doi:10.1666/0022-3360(2002)076<0287:LECSSF>2.0.CO;2. JSTOR 1307143..
- [51]
^Frýda, J.; Nützel, A.; Wagner, P.J. (2008). "Paleozoic Gastropoda". In Ponder, W.F.; Lindberg, D.R. Phylogeny and evolution of the Mollusca. California Press. pp. 239–264. ISBN 978-0-520-25092-5..
- [52]
^Kouchinsky, A. (2000). "Shell microstructures in Early Cambrian molluscs" (PDF). Acta Palaeontologica Polonica. 45 (2): 119–150. Retrieved 2009-11-04..
- [53]
^Hagadorn, J.W. & Waggoner, B.M. (2002). "The Early Cambrian problematic fossil Volborthella: New insights from the Basin and Range". In Corsetti, F.A. Proterozoic-Cambrian of the Great Basin and Beyond, Pacific Section SEPM Book 93 (PDF). SEPM (Society for Sedimentary Geology). pp. 135–150. Archived from the original on 2006-09-11.CS1 maint: BOT: original-url status unknown (link).
- [54]
^Vickers-Rich, P.; Fenton, C.L.; Fenton, M.A.; Rich, T.H. (1997). The Fossil Book: A Record of Prehistoric Life. Courier Dover Publications. pp. 269–272. ISBN 978-0-486-29371-4..
- [55]
^Marshall C.R.; Ward P.D. (1996). "Sudden and Gradual Molluscan Extinctions in the Latest Cretaceous of Western European Tethys". Science. 274 (5291): 1360–1363. Bibcode:1996Sci...274.1360M. doi:10.1126/science.274.5291.1360. PMID 8910273..
- [56]
^Monks, N. "A Broad Brush History of the Cephalopoda". Retrieved 2009-03-21..
- [57]
^Pojeta, J. (2000). "Cambrian Pelecypoda (Mollusca)". American Malacological Bulletin. 15: 157–166..
- [58]
^Schneider, J.A. (2001). "Bivalve systematics during the 20th century". Journal of Paleontology. 75 (6): 1119–1127. doi:10.1666/0022-3360(2001)075<1119:BSDTC>2.0.CO;2..
- [59]
^Gubanov, A.P.; Kouchinsky, A.V.; Peel, J.S. (2007). "The first evolutionary-adaptive lineage within fossil molluscs". Lethaia. 32 (2): 155. doi:10.1111/j.1502-3931.1999.tb00534.x..
- [60]
^Gubanov, A.P.; Peel, J.S. (2003). "The early Cambrian helcionelloid mollusc Anabarella Vostokova". Palaeontology. 46 (5): 1073–1087. doi:10.1111/1475-4983.00334..
- [61]
^Zong-Jie, F. (2006). "An introduction to Ordovician bivalves of southern China, with a discussion of the early evolution of the Bivalvia". Geological Journal. 41 (3–4): 303–328. doi:10.1002/gj.1048..
- [62]
^Raup, D.M.; Jablonski, D. (1993). "Geography of end-Cretaceous marine bivalve extinctions". Science. 260 (5110): 971–973. Bibcode:1993Sci...260..971R. doi:10.1126/science.11537491. PMID 11537491..
- [63]
^Malinky, J.M. (2009). "Permian Hyolithida from Australia: The Last of the Hyoliths?". Journal of Paleontology. 83: 147–152. doi:10.1666/08-094R.1..
- [64]
^Goloboff, Pablo A.; Catalano, Santiago A.; Mirande, J. Marcos; Szumik, Claudia A.; Arias, J. Salvador; Källersjö, Mari; Farris, James S. (2009). "Phylogenetic analysis of 73 060 taxa corroborates major eukaryotic groups". Cladistics. 25 (3): 211–230. doi:10.1111/j.1096-0031.2009.00255.x..
- [65]
^Sigwart, J.D.; Sutton, M.D. (October 2007). "Deep molluscan phylogeny: synthesis of palaeontological and neontological data". Proceedings of the Royal Society B. 274 (1624): 2413–2419. doi:10.1098/rspb.2007.0701. PMC 2274978. PMID 17652065. For a summary, see "The Mollusca". University of California Museum of Paleontology. Retrieved 2008-10-02..
- [66]
^"Introduction to the Lophotrochozoa". University of California Museum of Paleontology. Retrieved 2008-10-02..
- [67]
^Henry, J.; Okusu, A.; Martindale, M. (2004). "The cell lineage of the polyplacophoran, Chaetopleura apiculata: variation in the spiralian program and implications for molluscan evolution". Developmental Biology. 272 (1): 145–160. doi:10.1016/j.ydbio.2004.04.027. PMID 15242797..
- [68]
^Jacobs, D.K.; Wray, C. G.; Wedeen, C. J.; Kostriken, R.; Desalle, R.; Staton, J. L.; Gates, R.D.; Lindberg, D.R. (2000). "Molluscan engrailed expression, serial organization, and shell evolution". Evolution & Development. 2 (6): 340–347. doi:10.1046/j.1525-142x.2000.00077.x. PMID 11256378..
- [69]
^Giribet, G.; Okusu, A.; Lindgren, A.R.; Huff, S.W.; Schrödl, M.; Nishiguchi, M.K. (May 2006). "Evidence for a clade composed of molluscs with serially repeated structures: monoplacophorans are related to chitons". Proceedings of the National Academy of Sciences of the United States of America. 103 (20): 7723–7728. Bibcode:2006PNAS..103.7723G. doi:10.1073/pnas.0602578103. PMC 1472512. PMID 16675549..
- [70]
^Passamaneck, Y.; Schander, C.; Halanych, K. (2004). "Investigation of molluscan phylogeny using large-subunit and small-subunit nuclear rRNA sequences". Molecular Phylogenetics & Evolution. 32 (1): 25–38. doi:10.1016/j.ympev.2003.12.016. PMID 15186794..
- [71]
^Wilson, N.; Rouse, G.; Giribet, G. (2010). "Assessing the molluscan hypothesis Serialia (Monoplacophora+Polyplacophora) using novel molecular data". Molecular Phylogenetics & Evolution. 54 (1): 187–193. doi:10.1016/j.ympev.2009.07.028. PMID 19647088..
- [72]
^Wägele, J.; Letsch, H.; Klussmann-Kolb, A.; Mayer, C.; Misof, B.; Wägele, H. (2009). "Phylogenetic support values are not necessarily informative: the case of the Serialia hypothesis (a mollusk phylogeny)". Frontiers in Zoology. 6 (1): 12. doi:10.1186/1742-9994-6-12. PMC 2710323. PMID 19555513..
- [73]
^Vinther, J.; Sperling, E. A.; Briggs, D. E. G.; Peterson, K. J. (2011). "A molecular palaeobiological hypothesis for the origin of aplacophoran molluscs and their derivation from chiton-like ancestors". Proceedings of the Royal Society B: Biological Sciences. 279 (1732): 1259–68. doi:10.1098/rspb.2011.1773. PMC 3282371. PMID 21976685..
- [74]
^Mannino, M.A.; Thomas, K.D. (2002). "Depletion of a resource? The impact of prehistoric human foraging on intertidal mollusc communities and its significance for human settlement, mobility and dispersal". World Archaeology. 33 (3): 452–474. doi:10.1080/00438240120107477. JSTOR 827879..
- [75]
^Garrow, J.S.; Ralph, A.; James, W.P.T. (2000). Human Nutrition and Dietetics. Elsevier Health Sciences. p. 370. ISBN 978-0-443-05627-7..
- [76]
^"China catches almost 11 m tonnes of molluscs in 2005". FAO. Retrieved 2008-10-03..
- [77]
^"Importing fishery products or bivalve molluscs". United Kingdom: Food Standards Agency. Retrieved 2008-10-02..
- [78]
^Ruppert, pp. 300–343.
- [79]
^The fourth-century BC historian Theopompus, cited by Athenaeus (12:526) around 200 BC ; according to Gulick, C.B. (1941). Athenaeus, The Deipnosophists. Cambridge, Massachusetts: Harvard University Press. ISBN 978-0-674-99380-8..
- [80]
^Reese, D.S. (1987). "Palaikastro Shells and Bronze Age Purple-Dye Production in the Mediterranean Basin". Annual of the British School of Archaeology at Athens. 82: 201–6. doi:10.1017/s0068245400020438..
- [81]
^Stieglitz, R.R. (March 1994). "The Minoan Origin of Tyrian Purple". Biblical Archaeologist. 57 (1): 46–54. doi:10.2307/3210395. JSTOR 3210395..
- [82]
^Webster's Third New International Dictionary (Unabridged) 1976. G. & C. Merriam Co., p. 307..
- [83]
^Turner, R.D.; Rosewater, J. (June 1958). "The Family Pinnidae in the Western Atlantic". Johnsonia. 3 (38): 294..
- [84]
^Maurer, B. (October 2006). "The Anthropology of Money" (PDF). Annual Review of Anthropology. 35: 15–36. doi:10.1146/annurev.anthro.35.081705.123127. Archived from the original (PDF) on 2007-08-16..
- [85]
^Hogendorn, J. & Johnson, M. (2003). The Shell Money of the Slave Trade. Cambridge University Press. ISBN 978-0521541107. Particularly chapters "Boom and slump for the cowrie trade" (pages 64–79) and "The cowrie as money: transport costs, values and inflation" (pages 125–147).
- [86]
^Université Bordeaux; et al. "MolluSCAN eye project". Retrieved 2017-01-28..
- [87]
^Williamson, J.A.; Fenner, P.J.; Burnett, J.W.; Rifkin, J. (1996). Venomous and Poisonous Marine Animals: A Medical and Biological Handbook. UNSW Press. pp. 65–68. ISBN 978-0-86840-279-6..
- [88]
^Anderson, R.C. (1995). "Aquarium husbandry of the giant Pacific octopus". Drum and Croaker. 26: 14–23..
- [89]
^Alafaci, A. (5 June 2018). "Blue ringed octopus". Australian Venom Research Unit. Retrieved 2008-10-03..
- [90]
^Brazzelli, V.; Baldini, F.; Nolli, G.; Borghini, F.; Borroni, G. (March 1999). "Octopus apollyon bite". Contact Dermatitis. 40 (3): 169–70. doi:10.1111/j.1600-0536.1999.tb06025.x. PMID 10073455..
- [91]
^Anderson, R.C. (1999). "An octopus bite and its treatment". The Festivus. 31: 45–46..
- [92]
^Concar, D. (19 October 1996). "Doctor snail—Lethal to fish and sometimes even humans, cone snail venom contains a pharmacopoeia of precision drugs". New Scientist. Retrieved 2008-10-03..
- [93]
^Livett, B. "Cone Shell Mollusc Poisoning, with Report of a Fatal Case". Department of Biochemistry and Molecular Biology, University of Melbourne..
- [94]
^Haddad Junior, V.; Paula Neto, J.O.B.D.; Cobo, V.L.J. (September–October 2006). "Venomous mollusks: The risks of human accidents by conus snails (gastropoda: Conidae) in Brazil". Revista da Sociedade Brasileira de Medicina Tropical. 39 (5): 498–500. doi:10.1590/S0037-86822006000500015. PMID 17160331..
- [95]
^"The Carter Center Schistosomiasis Control Program". The Carter Center. Retrieved 2008-10-03..
- [96]
^Brown, D.S. (1994). Freshwater Snails of Africa and Their Medical Importance. CRC Press. p. 305. ISBN 978-0-7484-0026-3..
- [97]
^Barker, G.M. (2002). Molluscs As Crop Pests. CABI Publications. ISBN 978-0-85199-320-1..
- [98]
^Civeyrel, L.; Simberloff, D. (October 1996). "A tale of two snails: is the cure worse than the disease?". Biodiversity and Conservation. 5 (10): 1231–1252. doi:10.1007/BF00051574..
暂无