单克隆抗体
编辑单克隆抗体(mAb或moAb)是由高度一致的免疫细胞制成的抗体,这些免疫细胞是单一亲本细胞的所有克隆。单克隆抗体具有单价亲和力,因为它们结合相同的表位(抗体识别抗原的部位)。相反,多克隆抗体结合多个表位,通常由几个不同的浆细胞(分泌抗体的免疫细胞)谱系组成。也可以通过将一种单克隆抗体的治疗靶点增加到两个表位来设计双特异性单克隆抗体。
几乎任何物质,都有可能产生特异性结合该物质的单克隆抗体,然后它们可以用来检测或纯化该物质。这种方法已经成为了生物化学、分子生物学和医学的重要工具。当mAb用作药物时,非专利药物名称以-mab结尾,许多免疫治疗专家使用mab一词。
目录编辑
1 历史编辑
“神奇子弹”的想法最早是由保罗·埃尔利希(Paul Ehrlich)提出的,他在20世纪初假设,如果可以制造一种选择性靶向致病生物体的化合物,那么针对该致病生物体的毒素就可以与选择性试剂一起输送到体内。他和梅契尼科夫(lie Metchnikoff)因这项工作获得了1908年诺贝尔生理或医学奖,这而且这项工作导致了1910年梅毒的有效治疗。
在20世纪70年代,B细胞癌多发性骨髓瘤被发现。据了解,这些癌性B细胞都产生单一类型的抗体(一种病变蛋白),这被用来研究抗体的结构,但还不可能产生对特定抗原有特异性的均一抗体。[1]
1975年,乔治·克勒(Georges Köhler)和色萨·米尔斯坦(César Milstein)成功地将骨髓瘤细胞系与B细胞融合,创造出能产生抗体的杂交瘤,这些抗体对已知抗原具有特异性,并具有永生性。[2] 他们因这项发现分享了1984年的诺贝尔生理或医学奖。[2]
1988年,格雷格·温特(Greg Winter)和他的团队开创了人源化单克隆抗体的技术,[3]消除了许多单克隆抗体在一些病人身上引起的反应。
2018年,詹姆斯·艾利森(James P. Allison)和本庶佑(Tasuku Honjo)获得诺贝尔生理或医学奖,因为他们发现了通过使用抑制性连接的单克隆抗体可抑制负面免疫调节,从而进行癌症治疗。
2 生产编辑
2.1 杂交瘤的发展
单克隆抗体生产背后的许多工作都源于杂交瘤的生产,这涉及鉴别抗原特异性血浆/浆膜细胞(ASPCs),这些细胞能产生对目的抗原的特异性抗体,以及将这些细胞与骨髓细胞融合。兔B细胞可用于形成兔杂交瘤。聚乙二醇用于融合相邻的质膜,[4] 但是成功率低,因此需要使用只有融合细胞才能生长的选择性培养基。这是可能的,因为骨髓瘤细胞已经失去了合成次黄嘌呤-鸟嘌呤-磷酸核糖转移酶(HGPRT)的能力,这是核酸补救合成所必需的酶。除非从头嘌呤合成途径也被破坏,否则HGPRT的缺乏对骨髓瘤细胞的存活来说不是问题。将细胞暴露在氨基蝶呤(一种叶酸类似物,可以抑制二氢叶酸还原酶的活性,DHFR)下,会使细胞无法利用从头合成途径,成为核酸的完全营养缺陷型,因此需要补充(相应的核酸)才能存活。
选择培养基被称为HAT培养基,因为它含有次黄嘌呤、氨基蝶呤和胸腺嘧啶。该培养基对融合(杂交瘤)细胞具有选择性。未融合的骨髓瘤细胞不能生长,因为它们缺乏HGPRT,因此不能进行脱氧核糖核酸的复制。未融合的脾细胞不能无限期生长,因为它们的寿命有限。只有融合的杂交细胞,被称为杂交瘤,才能在培养基中无限期生长,因为脾细胞配体提供HGPRT,骨髓瘤配体具有使其永生的特征(类似于癌细胞)。
然后稀释细胞混合物,在微量滴定孔中从单亲细胞生长克隆。然后检测不同克隆分泌的抗体结合抗原的能力(用酶联免疫吸附试验或抗原微阵列检测法)或免疫斑点印迹。然后选择最高产、最稳定的克隆供将来使用。
杂交瘤可以在合适的细胞培养基中无限期生长。它们也可以注射到小鼠体内(腹腔内,肠道周围)。在那里,它们产生肿瘤,分泌一种富含抗体的液体,称为腹水。
培养基在体外选择过程中必须充裕富集,以进一步促进杂交瘤生长。这可以通过使用一层饲养纤维细胞或补充培养基(如briclone培养基)来实现。可以使用巨噬细胞处理过的培养基。通常优先选择通过细胞培养来产生单克隆抗体,因为腹水技术对动物是有害的。如果存在替代技术,腹水被认为是不道德的。[5]
2.2 新型mAb开发技术
最近开发了几种(新的)单克隆抗体技术,例如噬菌体展示,单个B细胞培养,[6] 来自不同B细胞群体的单细胞扩增,[7][8][9][10][11] 和单个浆细胞询问技术。与传统杂交瘤技术不同,新技术利用分子生物学技术通过聚合酶链式反应扩增抗体基因的重链和轻链,并利用重组技术在细菌或哺乳动物系统中生产。新技术的优点之一是适用于多种动物,如兔子、美洲驼、鸡和实验室中其他常见的实验动物。
2.3 提纯
在获得培养杂交瘤的培养基样品或腹水样品后,必须提取所需的抗体。杂交瘤细胞培养样品污染物主要由培养基成分组成,如生长因子、激素和转铁蛋白。相反,体内样品可能含有宿主抗体、蛋白酶、核酸酶、核酸和病毒。在这两种情况下,都可能存在杂交瘤的其他分泌物,如细胞因子。还可能存在细菌污染,因此可能存在细菌分泌的内毒素。根据细胞培养所需培养基的复杂性以及污染物,选择其中的一种(体内或体外)方法。
样品首先经过处理,或准备进行纯化。首先去除细胞、细胞碎片、脂质和凝结的物质,通常通过离心来实现,然后用孔径为0.45微米的过滤器进一步过滤。这些大颗粒会在后面的纯化步骤中导致一种叫做膜污染的现象。此外,样品中抗体的浓度可能不够,尤其所需的抗体是由低分泌细胞系产生时。因此,样品需要通过超滤或透析进行浓缩。
大多数带电杂质通常是阴离子,如核酸和内毒素。这些可以通过离子交换色谱分离。[12] 要么利用阳离子交换色谱,在足够低的酸碱度(pH)下使所需抗体结合到柱子上而使阴离子流穿;或者利用阴离子交换色谱,在足够高的pH下使所需抗体流穿而阴离子与柱结合。各种蛋白质也可以根据它们的等电点(pI)随着阴离子一起被分离。在蛋白质中,等电点(pI)被定义为蛋白质没有净电荷时的pH。当pH>PI时,蛋白质带净负电荷,当pH<PI时,蛋白质带净正电荷。例如,白蛋白的pI为4.8,明显低于大多数单克隆抗体6.1的PI值。因此,在4.8和6.1之间的pH下,白蛋白分子的平均电荷可能更倾向于带负电,而单克隆抗体分子带正电,因此可能将它们分离。另一方面,转铁蛋白的pI值为5.9,因此用这种方法很难(将其与单克隆抗体)分离。利用离子交换色谱法好的分离至少需要1的pI差。
转铁蛋白可以通过尺寸排阻色谱法去除。该方法是最可靠的色谱技术之一。因为我们处理的是蛋白质,电荷和亲和力等性质是不一致的,并且其分子随着pH变化而发生质子化或去质子化,而大小保持相对恒定。然而,它也有缺点,如分辨率低、容量低和洗脱时间短。
一种更快的单步分离方法是蛋白A/G亲和层析。抗体选择性结合蛋白A/G,因此可获得高纯度的抗体(通常> 80%)。然而,这种方法对于容易损坏的抗体来说可能存在问题,因为在纯化过程中通常会使用剧烈的条件。低pH可以破坏抗体与蛋白A/G之间形成的非共价键,从而将抗体从色谱柱中洗脱下来。除了可能影响抗体之外,低pH还会导致蛋白A/G从色谱柱中渗漏,并出现在洗脱样品中。采用高盐浓度的温和洗脱缓冲溶液系统可避免敏感抗体暴露于低pH值。成本也是该方法的一个重要考虑因素,因为固定化的蛋白A/G是一种更昂贵的树脂。
为了在单个步骤中达到最大纯度,可以进行亲和纯化,使用抗原来保证抗体的特异性。在这种方法中,用于产生抗体的抗原共价结合到琼脂糖载体上。如果抗原是一类多肽,它通常合成以半胱氨酸结尾,这允许在开发过程中将其选择性吸附于运输蛋白,如KLH蛋白,并用于纯化。然后,将含抗体的培养基与固定化的抗原一起孵育,成批或当抗体流经柱子时孵育,抗体在柱中选择性结合并保留下来,而杂质被洗掉。然后用低pH缓冲液或更温和的高盐洗脱缓冲液洗脱,从载体中回收纯化的抗体。
2.4 抗体异质性
产品异质性在单克隆抗体和其他重组生物产品中很常见,通常在上游表达过程中或者下游生产过程中被引入。
这些变体通常是聚集体、脱酰胺产物、糖基化变体、氧化氨基酸侧链以及氨基和羧基末端氨基酸的增加。[13] 这些看似微小的结构变化会影响临床前稳定性和过程优化,以及治疗产品的效力、生物利用度和免疫原性。普遍接受的纯化单克隆抗体方法的工艺流程包括用蛋白A捕获靶标产物,洗脱,酸化以失活潜在的哺乳动物病毒,随后用离子色谱法,首先用阴离子珠,然后用阳离子珠。
置换色谱法已被用于鉴定和表征这些通常看不见的变异体,其数量适合于随后的临床前评估方案,如动物药代动力学研究。[14][15] 在临床前开发阶段获得的知识对于增强产品质量理解至关重要,并为风险管理和提高监管灵活性提供了基础。最近,美国食品药品管理局的“按设计质量”计划试图为开发提供指导,并促进产品和工艺的设计,在提高产品可制造性的同时,最大限度地提高功效和安全性。[16]
2.5 重组体
重组单克隆抗体的生产包括抗体库技术或噬菌体展示/酵母展示技术。重组抗体工程包括利用病毒或酵母而不是小鼠来产生抗体。这些技术依赖于免疫球蛋白基因片段的快速克隆来创建氨基酸序列略有不同的抗体库,从中可以选择具有所需特异性的抗体。[17]噬菌体抗体库是噬菌体抗原库的变体。[18]这些技术可用于增强抗体识别抗原的特异性,其在各种环境条件下的稳定性、其治疗效果以及其在诊断应用中的可检测性。[19]发酵室已用于大规模抗体的生产。
2.6 嵌合抗体
虽然小鼠抗体和人抗体在结构上相似,但它们之间的差异足以在将小鼠单克隆抗体注射到人体内时引发免疫反应,导致它们从血液中快速清除,以及全身性炎症效应和人抗小鼠抗体(HAMA)的产生。
自20世纪80年代末以来,人们一直在探索重组脱氧核糖核酸,以增加停留时间。在一种方法中,编码小鼠单克隆抗体结合部分的脱氧核糖核酸与人产生抗体的脱氧核糖核酸在活细胞中整合。通过细胞培养表达这种“嵌合”或“人源化”的脱氧核糖核酸从而产生了部分小鼠抗体,部分人抗体。[20]
2.7 人类抗体
自从发现可以产生单克隆抗体以来,科学家们就致力于创造纯人源抗体,以减少人源化或嵌合抗体的副作用。已经确定了两种成功的方法:转基因小鼠[21]和噬菌体展示。
截至2016年11月,市场上19种纯人源单克隆抗体疗法中有13种来自转基因小鼠技术。
采用转基因技术的组织包括:
- medarex——销售UltiMab平台。2009年7月,百时美施贵宝公司收购了medarex[22]
- abgenix——销售Xenomouse技术。Abgenix于2006年4月被安进收购。[23]
- 雷根龙制药公司VelocImmune技术。[24]
- Kymab -销售其Kymouse技术的人。[25]
- 开放式单克隆技术的OmniRat和OmniMouse平台。[26]
- TRIANNI,Inc .–销售他们的TRIANNI小鼠平台。[25]
- Ablexis,LLC -销售他们的AlivaMab小鼠平台。[27]
噬菌体展示可用于在丝状噬菌体外壳蛋白(噬菌体主要外壳蛋白)上表达抗体可变结构域。[28][29][30]这些噬菌体展示抗体可用于各种研究应用。[31][32]ProAb于1997年12月宣布[33] ,涉及针对患病和非患病组织抗体库的高通量筛选,而Proximol使用自由基酶促反应来标记给定蛋白质附近的分子。[34][35]
单克隆抗体已被批准用于治疗癌症、心血管疾病、炎症性疾病、黄斑变性、移植排斥、多发性硬化和病毒感染。
2006年8月,美国药物研究和制造商协会发布报告指出,美国公司在临床试验中有160种不同的单克隆抗体,正等待食品和药物管理局的批准。[36]
3 应用程序编辑
3.1 诊断测试
一旦针对特定物质的单克隆抗体产生,它们就可以用来检测这种物质的存在。蛋白质印迹试验和免疫斑点印迹可以检测膜上的蛋白质。它们在免疫组织化学和免疫荧光试验中也非常有用,免疫组织化学用于检测固定组织切片中的抗原,免疫荧光试验用于检测冷冻组织切片或活细胞中的物质。
3.2 分析和化学用途
抗体也可以用免疫沉淀的方法从混合物中纯化它们的目标化合物。
3.3 治疗用途
治疗性单克隆抗体通过多种机制发挥作用,例如阻断靶分子功能、诱导细胞(表达靶标分子的细胞)凋亡或调节信号通路。[37][38]
癌症治疗
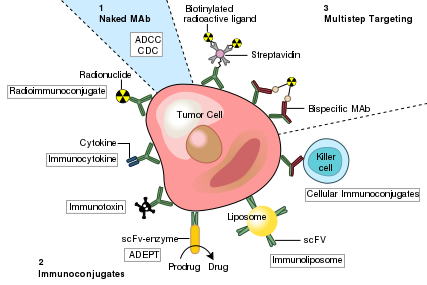
一种癌症的可能治疗方法是利用单克隆抗体,其仅结合癌细胞特异性抗原并诱导针对靶癌细胞的免疫反应。这种单克隆抗体可以被修饰用于递送毒素、放射性同位素、细胞因子或其他活性缀合物,或者设计双特异性抗体,该抗体可以与它们的Fab区结合以靶向抗原和缀合物或效应细胞。每一种完整的抗体都可以通过其Fc区与细胞受体或其他蛋白质结合。
截至2005年,美国食品和药物管理局批准的单克隆抗体(用于癌症)包括:[39]
- 阿伦组单抗
- 贝伐单抗
- 西妥昔单抗
- 奥米左星单抗
- 伊匹单抗
- 奥法木单抗
- 帕尼单抗
- 彭布罗利珠单抗
- 雷珠单抗
- 利妥昔单抗
- 曲妥珠单抗
自身免疫性疾病
用于自身免疫性疾病的单克隆抗体包括英夫利昔单抗和阿达木单抗,它们通过结合和抑制肿瘤坏死因子-α对类风湿性关节炎、克罗恩病、溃疡性结肠炎和强直性脊柱炎等疾病发挥作用。[40] 巴西利昔单抗和达丽珠单抗抑制活化的T细胞上的白细胞介素-2,从而有助于防止肾移植的急性排斥反应。[40]奥马珠单抗抑制人免疫球蛋白E(IgE),可用于治疗中重度过敏性哮喘。
治疗性单克隆抗体的例子
用于研究应用的单克隆抗体可以直接从抗体供应商处找到,或者通过使用像CiteAb这样的专业搜索引擎找到。下面是临床上重要的单克隆抗体的例子。
| 主要类别 | 类型 | 应用 | 机制/靶标 | 形式 |
|---|---|---|---|---|
| 抗炎症 | 英夫利昔单抗[40] |
|
抑制肿瘤坏死因子-α | 嵌合体 |
| 阿达木单抗 |
|
抑制肿瘤坏死因子-α | 人源 | |
| 巴西利昔单抗[40] |
|
抑制活化的T细胞上的白细胞介素-2 | 嵌合体 | |
| 达利珠单抗[40] |
|
抑制活化的T细胞上的白细胞介素-2 | 人源化 | |
| 奥马珠单抗 |
|
抑制人免疫球蛋白E | 人源化 | |
| 抗癌 | 吉妥珠单抗[40] |
|
靶向骨髓细胞表面抗原CD33的白血病细胞 | 人源化 |
| 阿伦组单抗[40] |
|
靶向T淋巴细胞和B淋巴细胞上的抗原CD52 | 人源化 | |
| 利妥昔单抗[40] |
|
靶向B淋巴细胞上的磷酸蛋白CD20 | 嵌合体 | |
| 曲妥单抗 |
|
靶向HER2/neu (erbB2)受体 | 人源化 | |
| 尼妥珠单抗 |
|
表皮生长因子抑制剂 | 人源化 | |
| 西妥昔单抗 |
|
表皮生长因子抑制剂 | 嵌合体 | |
| 贝伐单抗&雷珠单抗 |
|
抑制血管内皮生长因子 | 人源化 | |
| 抗癌和抗病毒 | 巴维妥昔单抗[41] |
|
免疫疗法,靶向磷脂酰丝氨酸[41] | 嵌合体 |
| 其他的 | 帕利珠单抗[40] |
|
抑制呼吸道合胞病毒融合蛋白 | 人源化 |
| 阿昔单抗[40] |
|
抑制血小板上的GpIIb/IIIa受体 | 嵌合体 |
参考文献
- [1]
^Tansey EM, Catterall PP (Jul 1994). "Monoclonal antibodies: a witness seminar in contemporary medical history". Med. Hist. 38 (3): 322–7. doi:10.1017/s0025727300036632. PMC 1036884. PMID 7934322..
- [2]
^Marks LV, A Healthcare Revolution in the Making: The Story of César Milstein and Monoclonal Antibodies: Making monoclonal antibodies.
- [3]
^Riechmann L, Clark M, Waldmann H, Winter G (1988). "Reshaping human antibodies for therapy". Nature. 332 (6162): 323–7. Bibcode:1988Natur.332..323R. doi:10.1038/332323a0. PMID 3127726..
- [4]
^Yang J1, Shen MH. Polyethylene glycol-mediated cell fusion. Methods Mol Biol. 2006; 325:59-66..
- [5]
^National Research Council (US) Committee on Methods of Producing Monoclonal Antibodies. Recommendation 1: Executive Summary: Monoclonal Antibody Production. Washington (DC): National Academies Press (US); 1999. ISBN 978-0-309-07511-4.
- [6]
^Seeber, Stefan; Ros, Francesca; Thorey, Irmgard; Tiefenthaler, Georg; Kaluza, Klaus; Lifke, Valeria; Fischer, Jens André Alexander; Klostermann, Stefan; Endl, Josef (2014). "A Robust High Throughput Platform to Generate Functional Recombinant Monoclonal Antibodies Using Rabbit B Cells from Peripheral Blood". PLoS ONE. 9 (2): e86184. Bibcode:2014PLoSO...986184S. doi:10.1371/journal.pone.0086184. PMC 3913575. PMID 24503933..
- [7]
^Wardemann, Hedda; Yurasov, Sergey; Schaefer, Anne; Young, James W.; Meffre, Eric; Nussenzweig, Michel C. (2003-09-05). "Predominant autoantibody production by early human B cell precursors". Science. 301 (5638): 1374–1377. Bibcode:2003Sci...301.1374W. doi:10.1126/science.1086907. ISSN 1095-9203. PMID 12920303..
- [8]
^Koelsch, Kristi; Zheng, Nai-Ying; Zhang, Qingzhao; Duty, Andrew; Helms, Christina; Mathias, Melissa D.; Jared, Mathew; Smith, Kenneth; Capra, J. Donald (2007-06-01). "Mature B cells class switched to IgD are autoreactive in healthy individuals". The Journal of Clinical Investigation. 117 (6): 1558–1565. doi:10.1172/JCI27628. ISSN 0021-9738. PMC 1866247. PMID 17510706..
- [9]
^Smith, Kenneth; Garman, Lori; Wrammert, Jens; Zheng, Nai-Ying; Capra, J. Donald; Ahmed, Rafi; Wilson, Patrick C. (2009-01-01). "Rapid generation of fully human monoclonal antibodies specific to a vaccinating antigen". Nature Protocols. 4 (3): 372–384. doi:10.1038/nprot.2009.3. ISSN 1750-2799. PMC 2750034. PMID 19247287..
- [10]
^Duty, J. Andrew; Szodoray, Peter; Zheng, Nai-Ying; Koelsch, Kristi A.; Zhang, Qingzhao; Swiatkowski, Mike; Mathias, Melissa; Garman, Lori; Helms, Christina (2009-01-16). "Functional anergy in a subpopulation of naive B cells from healthy humans that express autoreactive immunoglobulin receptors". The Journal of Experimental Medicine. 206 (1): 139–151. doi:10.1084/jem.20080611. ISSN 1540-9538. PMC 2626668. PMID 19103878..
- [11]
^Huang, Jinghe; Doria-Rose, Nicole A.; Longo, Nancy S.; Laub, Leo; Lin, Chien-Li; Turk, Ellen; Kang, Byong H.; Migueles, Stephen A.; Bailer, Robert T. (2013-10-01). "Isolation of human monoclonal antibodies from peripheral blood B cells". Nature Protocols (in 英语). 8 (10): 1907–1915. doi:10.1038/nprot.2013.117. ISSN 1754-2189. PMC 4844175. PMID 24030440..
- [12]
^Vlasak J, Ionescu R (2008). "Hetergeneity of Monoclonal Antibodies Revealed by Charge-Sensitive Methods". Current Pharmaceutical Biotechnology. 9 (6): 468–481. doi:10.2174/138920108786786402. PMID 19075686..
- [13]
^Beck A, Wurch T, Bailly C, Corvaia N (May 2010). "Strategies and challenges for the next generation of therapeutic antibodies". Nat. Rev. Immunol. 10 (5): 345–52. doi:10.1038/nri2747. PMID 20414207..
- [14]
^Khawli LA, Goswami S, Hutchinson R, Kwong ZW, Yang J, Wang X, Yao Z, Sreedhara A, Cano T, Tesar D, Nijem I, Allison DE, Wong PY, Kao YH, Quan C, Joshi A, Harris RJ, Motchnik P (2010). "Charge variants in IgG1: Isolation, characterization, in vitro binding properties and pharmacokinetics in rats". mAbs. 2 (6): 613–24. doi:10.4161/mabs.2.6.13333. PMC 3011216. PMID 20818176..
- [15]
^Zhang T, Bourret J, Cano T (August 2011). "Isolation and characterization of therapeutic antibody charge variants using cation exchange displacement chromatography". J Chromatogr A. 1218 (31): 5079–86. doi:10.1016/j.chroma.2011.05.061. PMID 21700290..
- [16]
^Rathore AS, Winkle H (January 2009). "Quality by design for biopharmaceuticals". Nat. Biotechnol. 27 (1): 26–34. doi:10.1038/nbt0109-26. PMID 19131992..
- [17]
^Siegel DL (2002). "Recombinant monoclonal antibody technology". Transfusion Clinique et Biologique : Journal de la Société Française de Transfusion Sanguine. 9 (1): 15–22. doi:10.1016/S1246-7820(01)00210-5. PMID 11889896..
- [18]
^"Dr. George Pieczenik". LMB Alumni. MRC Laboratory of Molecular Biology (LMB). 17 September 2009..
- [19]
^Schmitz U, Versmold A, Kaufmann P, Frank HG (2000). "Phage display: a molecular tool for the generation of antibodies—a review". Placenta. 21 (Suppl A): S106–S112. doi:10.1053/plac.1999.0511. PMID 10831134..
- [20]
^Chadd HE, Chamow SM (April 2001). "Therapeutic antibody expression technology". Curr. Opin. Biotechnol. 12 (2): 188–94. doi:10.1016/S0958-1669(00)00198-1. PMID 11287236..
- [21]
^Lonberg N, Huszar D (1995). "Human antibodies from transgenic mice". Int. Rev. Immunol. 13 (1): 65–93. doi:10.3109/08830189509061738. PMID 7494109..
- [22]
^"Bristol-Myers Buys Medarex Drugmaker for $2.4 Billion (Update3)"..
- [23]
^"Amgen Completes Acquisition of Abgenix; Acquisition Provides Amgen with Full Ownership of Panitumumab and Eliminates a Denosumab Royalty"..
- [24]
^"Archived copy". Archived from the original on June 29, 2009. Retrieved July 28, 2009.CS1 maint: Archived copy as title (link).
- [25]
^"Proprietary antibody platform"..
- [26]
^"Naturally optimized human antibodies"..
- [27]
^"Proprietary antibody platform"./.
- [28]
^McCafferty J, Griffiths AD, Winter G, Chiswell DJ (December 1990). "Phage antibodies: filamentous phage displaying antibody variable domains". Nature. 348 (6301): 552–4. Bibcode:1990Natur.348..552M. doi:10.1038/348552a0. PMID 2247164..
- [29]
^Marks JD, Hoogenboom HR, Bonnert TP, McCafferty J, Griffiths AD, Winter G (1991). "By-passing immunization". Journal of Molecular Biology. 222 (3): 581–97. doi:10.1016/0022-2836(91)90498-U. PMID 1748994..
- [30]
^Carmen S, Jermutus L (2002). "Concepts in antibody phage display". Briefings in Functional Genomics and Proteomics. 1 (2): 189–203. doi:10.1093/bfgp/1.2.189. PMID 15239904..
- [31]
^Osbourn JK (2002). Proximity-guided (ProxiMol) antibody selection. Methods Mol. Biol. 178. pp. 201–5. doi:10.1385/1-59259-240-6:201. ISBN 978-1-59259-240-1. PMID 11968489..
- [32]
^Abeloff, MD; Armitage, JO; Niederhuber, JE; Kastan, MB; McKenna, G (2008). "Therapeutic Antibodies and Immunologic Conjugates". Abeloff's Clinical Oncology (4th ed.). Elsevier..
- [33]
^"Cambridge Antibody Technology". Archived from the original on 2011-09-28..
- [34]
^Osbourn JK, Derbyshire EJ, Vaughan TJ, Field AW, Johnson KS (January 1998). "Pathfinder selection: in situ isolation of novel antibodies". Immunotechnology. 3 (4): 293–302. doi:10.1016/S1380-2933(97)10007-0. PMID 9530562..
- [35]
^"The Current State of Proteomic Technology"..
- [36]
^PhRMA Reports Identifies More than 400 Biotech Drugs in Development. Pharmaceutical Technology, August 24, 2006. Retrieved 2006-09-04..
- [37]
^FC Breedveld (2000). "Therapeutic monoclonal antibodies". The Lancet. 355 (9205): 735–40. doi:10.1016/S0140-6736(00)01034-5. PMID 10703815..
- [38]
^Australian Prescriber (2006). "Monoclonal antibody therapy for non-malignant disease"..
- [39]
^Takimoto CH, Calvo E. (January 01, 2005) "Principles of Oncologic Pharmacotherapy" in Pazdur R, Wagman LD, Camphausen KA, Hoskins WJ (Eds) Cancer Management.
- [40]
^Rang, H. P. (2003). Pharmacology. Edinburgh: Churchill Livingstone. pp. 241, for the examples infliximab, basiliximab, abciximab, daclizumab, palivusamab, gemtuzumab, alemtuzumab and rituximab, and mechanism and mode. ISBN 978-0-443-07145-4..
- [41]
^Staff, Adis Insight. Bavituximab profile Last updated Jan 27 2016.
- [42]
^"Monoclonal antibodies to treat cancer | American Cancer Society". www.cancer.org (in 英语). Retrieved 2018-04-19..
- [43]
^"Monoclonal antibody drugs for cancer: How they work". Mayo Clinic (in 英语). Retrieved 2018-04-19..
- [44]
^"Monoclonal Antibodies: List, Types, Side Effects & FDA Uses (Cancer)". MedicineNet (in 英语). Retrieved 2018-04-19..
暂无