双酚A
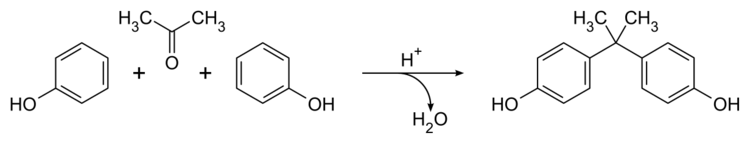
编辑双酚A (BPA)是一种有机合成化合物,化学式(CH3)2C(C6H4OH)2,属于双酚类苯基甲烷衍生物,具有两个羟苯基。它是一种无色固体,可溶于有机溶剂,但难溶于水(83℃时在水中的溶解度为0.344 wt %)。
双酚A是合成塑料的原料,主要用于制备某些聚碳酸酯和环氧树脂,以及一些聚砜和某些特殊材料。以BPA为基础的塑料透明而坚韧,可制成各种常见的消费品,如塑料瓶,包括水瓶、运动器材、CD和DVD。含有双酚A的环氧树脂被用来作为水管的内部涂层,作为许多食品和饮料罐内部的涂层,并用于制造销售收据中使用的热敏纸[1]。2015年,估计有400万吨双酚A化学品被用于生产聚碳酸酯塑料,使其成为全球产量最高的化学品之一[2]。
双酚A是一种异雌激素,表现出类似雌激素的性质[3],这引起了人们对其在某些消费品和食品容器中适用性的担忧。自2008年以来,多国政府已经对其安全性进行了调查,这促使一些零售商撤回了聚碳酸酯的产品。美国食品和药物管理局(FDA)已经根据市场原因而非安全性的原因终止了在瓶装和婴儿配方奶粉包装中使用双酚A的授权[4]。 欧盟和加拿大已经禁止在婴儿奶瓶中使用双酚A。
1 生产编辑
2 应用编辑
2003年,双酚A在美国的消费量为856000吨,其中72%用于生产聚碳酸酯塑料,21%用于生产环氧树脂[7]。 在美国,只有不到5%的双酚A被用于食品接触应用,但双酚A仍用于罐头食品工业和印刷应用,如用于打印销售收据[8][9]。
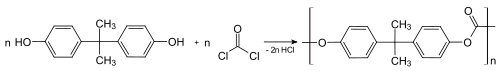
2.1 聚碳酸酯
双酚A和光气反应生成聚碳酸酯。反应在双相条件下进行;用碱的水溶液清除盐酸:
每年有数百万吨(80亿磅)的双酚A被用于这一目的[10]。
2.2 环氧树脂和乙烯基酯树脂
它是生产主要种类树脂的前驱体,特别是乙烯基酯树脂。树脂的生产通常从双酚A与环氧氯丙烷的烷基化开始[11]。
2.3 双酚A的衍生品
双酚A是一种多用途的构建模块,许多衍生物都是从双酚A制备出来的。双酚A硝化得到二硝基双酚A。溴化得到四溴双酚A(TBBPA),具有阻燃性能[12]。
双酚A也用于合成聚砜和一些聚醚醚酮。它是某些增塑剂中的抗氧化剂,在PVC中是一种聚合抑制剂。
双酚A已经开发出几种候选药物,包括Ralaniten、#Ralaniten acetate和EPI-001。
3 塑料中的标识编辑
4 历史编辑
双酚A是在1891年由俄罗斯化学家Aleksandr Dianin发现的[15]。
1934年,I.G. Farbenindustrie的工人报道了双酚A和环氧氯丙烷的偶联。在接下来的十年里,瑞士DeTrey Freres和美国DeVoe和Raynolds公司的工人描述了从类似材料中获得的涂料和树脂。这项早期工作为环氧树脂的发展奠定了基础,这反过来又推动了双酚A的生产[16]。随着拜耳公司和通用电气公司在聚碳酸酯塑料方面的发现,双酚A的应用进一步扩大。这些塑料首次出现于1958年,由Mobay、通用电气和拜耳生产[16]。
在内分泌干扰的争议方面,英国生物化学家Edward Charles Dodds在20世纪30年代初测试了双酚A作为人工雌激素的作用。他发现双酚A的效力是雌二醇的1 / 37000[16][17][18]。多德(Dodds)最终开发了一种结构相似的 化合物,己烯雌酚(DES),该化合物曾作为一种合成雌激素药物用于妇女和动物,但由于其致癌风险而被禁止;1971年DES被禁止在人体体内使用,1979年被禁止在动物体内使用[16]。双酚A从未被用作药物[16]。双酚A模仿天然雌激素作用的能力源自苯酚基团对双酚A和雌二醇上苯酚基团的相似性,这使得这种合成分子能够在体内触发雌激素的生成途径[19]。通常,与双酚A类似的含有苯酚基团的分子具有较弱的雌激素活性。因此它也被认为是内分泌干扰物(ED)和雌激素化学物质。 异种雌激素是双酚A隶属的另一个类别,因为它能够中断控制人类和动物生殖发育信号的网络[20]。
5 健康影响编辑
双酚A被发现与核雌激素受体(ERs)、ERα和ERβ结合[21]。 它比雌二醇的效力低1000到2000倍[21]。 双酚A既能模拟雌激素的作用,又能拮抗雌激素,表明它是选择性的雌激素受体调节剂(SERM)或雌激素受体的部分激动剂[21]。 在高浓度时,双酚A还能与雄激素受体结合并起拮抗作用[21]。除了受体结合,该化合物还被发现影响睾丸间质细胞类固醇生成,包括影响17α-羟化酶/17,20裂解酶和芳香酶的表达,并干扰黄体生成素受体-配体结合[21]。
1997年,实验室动物暴露于低剂量双酚A导致的不良影响被首次提出[21]。现代研究开始发现,怀孕和发育期间接触双酚A可能导致健康问题。截至2014年,关于是否应该禁止双酚A的研究和辩论仍在进行。
2007年的一项研究调查了双酚A和雌激素相关受体γ (ERR-γ)之间的相互作用。这种孤儿受体(内源性配体未知)表现为转录的组成型激活因子。双酚A似乎能强烈结合ERR-γ(解离常数= 5.5 nM),但与ER结合的作用很弱[22]。 双酚A与ERR-γ的结合保持了其基本的组成活性[22]。 它还能阻止ERR-γ对选择性ER调节剂SERM(4-羟基他莫昔芬)的钝化作用[22]。这可能是双酚A作为雌激素的作用机制[22]。人体不同部位ERR-γ的不同表达可能是双酚A效应变化的原因。双酚A也被发现是GPER(GPR30)的激动剂[23]。
根据欧洲食品安全局的说法,在目前的暴露水平下,双酚A不会对任何年龄组的消费者(包括未出生的儿童、婴儿和青少年)造成健康风险”[24]。但2017年,欧洲化学品管理局得出结论认为,由于其具有干扰内分泌的特性,双酚A应被列为一种高度关注的物质[25]。
2012年,美国食品和药物管理局禁止在婴儿奶瓶中使用双酚A[26]。
环境保护局(EPA)也认为双酚A不是一个健康问题。2011年,英国食品标准局首席科学家安德鲁·瓦奇(Andrew Wadge)对2011年美国关于成年人饮食暴露于双酚A的研究发表了评论[27]。他说,“这证实了其他独立的研究,并增加了双酚A被人体迅速吸收、解毒和消除的证据——因此这不是一个健康问题。”[28]
内分泌学会(Endocrine Society)在2015年表示,正在进行的实验室研究的结果使人们有理由担心干扰内分泌的化学物质——包括双酚A在环境中的潜在危害,并且基于预防原则,则应继续评估这些物质并对它们进行严格监管[29]。2016年的一份文献综述称,双酚A造成的潜在危害是一个科学争论的话题,因为双酚A暴露与不利于人类健康的影响(包括生殖和发育影响以及代谢疾病)之间存在关联,进一步研究是应该优先考虑的[30]。
5.1 双酚A替代品
由于担忧双酚A对健康的影响,许多制造商用双酚S(BPS)和二苯砜等替代品取代双酚A。然而,人们也对这些替代品提出了健康问题的担忧[31]。
6 环境影响编辑
2010年,美国环境保护署报告称,每年有100多万磅双酚A被释放到环境中[32]。 双酚A可以通过消费前和消费后的浸出释放到环境中。从消费前的角度来看,引入环境的常见途径直接来自化学塑料、涂料和染色制造商、在铸造砂中使用双酚A的铸造厂,或者双酚A和含双酚A的产品的运输[33][34]。消费后双酚A废物来自城市废水处理厂的废水排放、农业灌溉管道、海洋塑料垃圾、垃圾填埋场塑料、纸张和金属废物以及纸张或材料回收公司的间接浸出[33][34][35]。尽管双酚A在土壤和水中的半衰期为4.5天,在空气中的半衰期不到一天,双酚A的普遍存在使其成为一种重要的污染物。尽管双酚A具有生物降解性,而且对其生物积累的关注也很低,但它在水和土壤中蒸发的速率很低,这就带来了一些问题。双酚A在大气中挥发性低,蒸汽压在5.00至5.32 Pa之间。双酚A水溶液吸收波长大于250纳米[36]。
双酚A无处不在的特性使其成为一种重要的污染物。它干扰与细菌共生体Sinorhizobium melilot相关的豆科植物根部的固氮作用[37]。双酚A影响大豆幼苗的根系生长,硝酸盐生产、铵生产以及硝酸还原酶和亚硝酸还原酶的活性。低剂量双酚A能促进根系生长,增加根系硝酸盐含量,减少根系铵含量,硝酸盐和亚硝酸盐还原酶活性保持不变。然而,在双酚A浓度相当高的情况下,除了硝酸盐浓度的增加以及亚硝酸盐和硝酸还原酶活性的降低之外,其他所有效果均相反[38]。 氮既是植物的营养物质,也是植物生长发育的基础。
沉积物中双酚A的吸收量也随着温度的升高而减少,2006年对中国中南部湘江不同植物的研究证明了这一点。一般来说,随着温度的升高,化合物的水溶性会增加。因此,进入固相的沉积物的量将在平衡点处降低。。同时,双酚A在沉积物上的吸附过程是放热的,摩尔生成焓δH为负,自由能δG为负,摩尔熵δS为正。这表明双酚A的吸附是由焓驱动的。还观察到双酚A的吸附随着pH的增加而减少[39]。
2005年在美国进行的一项研究发现,在城市水处理厂的处理过程中,91-98%的双酚A可能被从水中去除[40]。关于双酚A的水反应的更详细的解释见下面的双酚A降解部分。然而,2009年对地表水系统中双酚A的荟萃分析显示,美国和欧洲的地表水和沉积物中存在双酚A[41]。根据加拿大环境部2011年的报告,目前在城市污水中可以发现双酚A。初步评估显示,低水平的双酚A会随着时间的推移对鱼类和生物造成伤害。”[42]
双酚A影响水生生物的生长、繁殖和发育。在淡水生物中,鱼类似乎是最敏感的物种。有证据表明,鱼类、水生无脊椎动物、两栖动物和爬行动物的内分泌相关影响与环境相关,其暴露水平低于急性毒性所需的暴露水平。内分泌相关效应的报告值存在广泛的差异,但许多差异在1微克/升至1毫克/升之间[43]。
2009年,英国皇家学会发表了一份关于增塑剂对野生动物的生物影响的综述,重点关注了水生和陆生环节动物、软体动物、甲壳动物、昆虫、鱼类和两栖动物,结论是双酚A影响所有研究动物群体的繁殖,损害甲壳动物和两栖动物的发育,并诱发遗传变异[43]。
参考文献
- [1]
^Pivnenko, K.; Pedersen, G. A.; Eriksson, E.; Astrup, T. F. (2015-10-01). "Bisphenol A and its structural analogues in household waste paper". Waste Management. 44: 39–47. doi:10.1016/j.wasman.2015.07.017. PMID 26194879..
- [2]
^"Archived copy". Archived from the original on 19 March 2017. Retrieved 24 January 2017.CS1 maint: Archived copy as title (link).
- [3]
^Egan, Michael (March 2014). "Sarah A. Vogel. Is It Safe? BPA and the Struggle to Define the Safety of Chemicals. xxi + 304 pp., illus., index. Berkeley: University of California Press, 2013". Isis. 105 (1): 254. doi:10.1086/676809. ISSN 0021-1753..
- [4]
^"Bisphenol A (BPA): Use in Food Contact Application". Fda.gov. November 2014. Retrieved June 21, 2018..
- [5]
^"Experts demand European action on plastics chemical". Reuters. 22 June 2010..
- [6]
^Uglea, Constantin V.; Negulescu, Ioan I. (1991). Synthesis and Characterization of Oligomers. CRC Press. p. 103. ISBN 978-0-8493-4954-6..
- [7]
^National Toxicology Program, U.S. Department of Health and Human Services (September 2008). "CERHR Expert Panel Report for Bisphenol A" (PDF). Archived from the original (PDF) on 9 November 2015. Retrieved 31 May 2013.CS1 maint: Uses authors parameter (link).
- [8]
^"Concern over canned foods". Consumer Reports. December 2009. Retrieved 2 February 2012..
- [9]
^"Soaring BPA Levels Found in People Who Eat Canned Foods". Fox News Channel. 23 November 2011..
- [10]
^"Polycarbonate (PC) Polymer Resin". Alliance Polymers, Inc. Archived from the original on 21 September 2009. Retrieved 2 August 2009..
- [11]
^Kroschwitz, Jacqueline I. Kirk-Othmer Encyclopedia of Chemical Technology. 5 (5 ed.). p. 8. ISBN 978-0-471-52695-7..
- [12]
^Dagani, M. J.; Barda, H. J.; Benya, T. J.; Sanders, D. C. (2005), "Bromine Compounds", Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, doi:10.1002/14356007.a04_405CS1 maint: Multiple names: authors list (link).
- [13]
^"Bisphenol A (BPA) Information for Parents". Hhs.gov. 15 January 2010. Retrieved 23 October 2011..
- [14]
^Biello D (19 February 2008). "Plastic (not) fantastic: Food containers leach a potentially harmful chemical". Scientific American. 2. Retrieved 9 April 2008..
- [15]
^See: А. Дианина (1891) "О продуктахъ конденсацiи кетоновъ съ фенолами" (On condensation products of ketones with phenols), Журнал Русского физико-химического общества (Journal of the Russian Physical Chemistry Society), 23 : 488-517, 523–546, 601–611; see especially pages 491-493 ("Диметилдифеиолметаиь" (dimethyldiphenolmethane)). Reprinted in condensed form in: A. Dianin (1892) "Condensationsproducte aus Ketonen und Phenolen" (Condensation products of ketones and phenols), Berichte der Deutschen chemischen Gesellschaft zu Berlin, 25, part 3 : 334-337..
- [16]
^Volker Serini "Polycarbonates" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2000. doi:10.1002/14356007.a21_207.
- [17]
^Dodds EC, Lawson W (1936). "Synthetic Œstrogenic Agents without the Phenanthrene Nucleus". Nature. 137 (3476): 996. Bibcode:1936Natur.137..996D. doi:10.1038/137996a0..
- [18]
^Dodds E. C.; Lawson W. (1938). "Molecular Structure in Relation to Oestrogenic Activity. Compounds without a Phenanthrene Nucleus". Proceedings of the Royal Society of London B: Biological Sciences. 125 (839): 222–232. Bibcode:1938RSPSB.125..222D. doi:10.1098/rspb.1938.0023..
- [19]
^Kwon J.H.; Katz L.E.; Liljestrand H.M. (2007). "Modeling binding equilibrium in a competitive estrogen receptor binding assay". Chemosphere. 69 (7): 1025–1031. Bibcode:2007Chmsp..69.1025K. doi:10.1016/j.chemosphere.2007.04.047. PMID 17559906..
- [20]
^Ramos, J.G. (2003). "Bisphenol A induces both transient and permanent histofunctional alterations of the hypothalamic-pituitary-gonadal axis in prenatally exposed male rats". Endocrinology. 144 (7): 3206–3215. doi:10.1210/en.2002-0198. PMID 12810577..
- [21]
^Hejmej, Anna; Kotula-Balak, Magorzata; Bilinsk, Barbara (2011). Antiandrogenic and Estrogenic Compounds: Effect on Development and Function of Male Reproductive System. Steroids – Clinical Aspect. doi:10.5772/28538. ISBN 978-953-307-705-5..
- [22]
^Matsushima A, Kakuta Y, Teramoto T, Koshiba T, Liu X, Okada H, Tokunaga T, Kawabata S, Kimura M, Shimohigashi Y (October 2007). "Structural evidence for endocrine disruptor bisphenol A binding to human nuclear receptor ERR gamma". J. Biochem. 142 (4): 517–24. doi:10.1093/jb/mvm158. PMID 17761695..
- [23]
^Prossnitz, Eric R.; Barton, Matthias (2014). "Estrogen biology: New insights into GPER function and clinical opportunities". Molecular and Cellular Endocrinology. 389 (1–2): 71–83. doi:10.1016/j.mce.2014.02.002. ISSN 0303-7207. PMC 4040308. PMID 24530924..
- [24]
^"Bisphenol A". European Food Safety Authority. 2015. Lay summary..
- [25]
^"MSC unanimously agrees that Bisphenol A is an endocrine disruptor - All news - ECHA". echa.europa.eu (in 英语). Retrieved 2017-06-19..
- [26]
^Mirmira, P; Evans-Molina, C (2014). "Bisphenol A, obesity, and type 2 diabetes mellitus: genuine concern or unnecessary preoccupation?". Translational Research (Review). 164 (1): 13–21. doi:10.1016/j.trsl.2014.03.003. hdl:1805/8373. PMC 4058392. PMID 24686036..
- [27]
^Teeguarden JG, Calafat AM, Ye X, Doerge DR, Churchwell MI, Gunawan R, Graham MK (September 2011). "Twenty-four hour human urine and serum profiles of bisphenol A during high-dietary exposure". Toxicological Sciences. 123 (1): 48–57. doi:10.1093/toxsci/kfr160. PMID 21705716..
- [28]
^Wage, Andrew (27 July 2011). "Small pond, same big issues". FSA. Archived from the original on 10 September 2011. Retrieved 3 August 2011..
- [29]
^Gore AC, Chappell VA, Fenton SE, Flaws JA, Nadal A, Prins GS, Toppari J, Zoeller RT (2015). "Executive Summary to EDC-2: The Endocrine Society's Second Scientific Statement on Endocrine-Disrupting Chemicals". Endocr. Rev. 36 (6): 593–602. doi:10.1210/er.2015-1093. PMC 4702495. PMID 26414233..
- [30]
^Giulivo M, Lopez de Alda M, Capri E, Barceló D (2016). "Human exposure to endocrine disrupting compounds: Their role in reproductive systems, metabolic syndrome and breast cancer. A review". Environ. Res. (Review). 151: 251–264. Bibcode:2016ER....151..251G. doi:10.1016/j.envres.2016.07.011. PMID 27504873..
- [31]
^"BPA substitutes may be just as bad as the popular consumer plastic". 2018-09-13..
- [32]
^Erler C, Novak J (October 2010). "Bisphenol a exposure: human risk and health policy". J Pediatr Nurs. 25 (5): 400–7. doi:10.1016/j.pedn.2009.05.006. PMID 20816563..
- [33]
^Corrales, Jone; Kristofco, Lauren A.; Steele, W. Baylor; Yates, Brian S.; Breed, Christopher S.; Williams, E. Spencer; Brooks, Bryan W. (2015-07-29). "Global Assessment of Bisphenol A in the Environment". Dose-Response. 13 (3): 1559325815598308. doi:10.1177/1559325815598308. ISSN 1559-3258. PMC 4674187. PMID 26674671..
- [34]
^EPA (26 July 2011). "Testing of Bisphenol A, Advance notice of proposed rulemaking (ANPRM)". Federal Register /Vol. 76, No. 143 / Proposed Rules. Federal Register. Retrieved 8 May 2017..
- [35]
^"Plastic Breaks Down in Ocean, After All -- And Fast". news.nationalgeographic.com. 2009-08-20. Retrieved 2017-11-27..
- [36]
^Abo, Rudy (September 2016). "Optimized photodegradation of Bisphenol A in water using ZnO, TiO2, and SnO2 and photocatalysts under UV radiation as a decontamination procedure" (PDF). Drinking Water Engineering and Science. 9 (2): 27–35. doi:10.5194/dwes-9-27-2016..
- [37]
^Fox, Jennifer E.; Gulledge, Jay; Engelhaupt, Erika; Burow, Matthew E.; McLachlan, John A. (2007-06-12). "Pesticides reduce symbiotic efficiency of nitrogen-fixing rhizobia and host plants". Proceedings of the National Academy of Sciences (in 英语). 104 (24): 10282–10287. Bibcode:2007PNAS..10410282F. doi:10.1073/pnas.0611710104. ISSN 0027-8424. PMC 1885820. PMID 17548832..
- [38]
^Sun, Hai; Wang, Lihong; Zhou, Qing (January 2013). "Effects of bisphenol A on growth and nitrogen nutrition of roots of soybean seedlings". Environmental Toxicology and Chemistry. 32 (1): 174–180. doi:10.1002/etc.2042. ISSN 1552-8618. PMID 23109293..
- [39]
^Zeng, Guangming; Zhang, Chang; Huang, Guohe; Yu, Jian; Wang, Qin; Li, Jianbing; Xi, Beidou; Liu, Hongliang (2006-11-01). "Adsorption behavior of bisphenol A on sediments in Xiangjiang River, Central-south China". Chemosphere. 65 (9): 1490–1499. Bibcode:2006Chmsp..65.1490Z. doi:10.1016/j.chemosphere.2006.04.013. PMID 16737729..
- [40]
^Drewes, J. E.; Hemming, J.; Ladenburger, S. J.; Schauer, J.; Sonzogni, W. An assessment of endocrine disrupting activity changes during wastewater treatment through the use of bioassays and chemical measurements. Water Environ. Res. 2005, 77, 12–23..
- [41]
^Klečka, G., Staples, C., Clark, K., Anderhoeven, N., Thomas, D. and Hentges, S. (2009). "Exposure analysis of Bisphenol A in surface water systems in North America and Europe". Environ. Sci. Technol. 43 (16): 6145–6150. Bibcode:2009EnST...43.6145K. doi:10.1021/es900598e.CS1 maint: Uses authors parameter (link).
- [42]
^"Bisphenol A Fact Sheet". Government of Canada. Archived from the original on 23 April 2011. Retrieved 1 February 2012..
- [43]
^"Bisphenol A Action Plan" (PDF). U.S. Environmental Protection Agency. 29 March 2010. Retrieved 12 April 2010..
- [44]
^Fiege H; Voges H-W; Hamamoto T; Umemura S; Iwata T; Miki H; Fujita Y; Buysch H-J; Garbe D; Paulus W (2000). "Phenol Derivatives". Ullmann's Encyclopedia of Industrial Chemistry. Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a19_313. ISBN 978-3527306732..
暂无