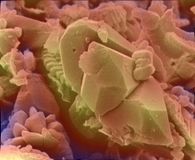
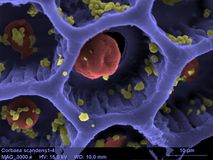
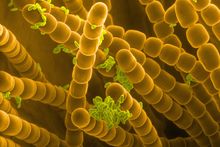
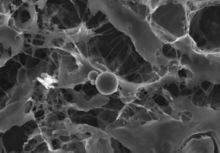
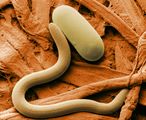
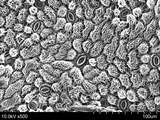
扫描电子显微镜
编辑扫描电子显微镜(Scanning Electron Microscope, SEM)是一种电子显微镜,它通过用聚焦电子束扫描表面来产生样品的图像。电子与样品中的原子相互作用,产生包含样品表面形貌和成分信息的各种信号。电子束的扫描路径形如光栅,将电子束的位置与检测信号的强度相结合即可输出图像。在最常见的SEM模式下,用艾弗哈特-索恩利(Everhart-Thornley)探测器可以检测到由电子束轰击原子所激发的二次电子。不考虑其它因素,可以检测到的二次电子数以及信号强度取决于样品形貌。扫描电镜的分辨率可达1 nm。
一般的SEM中,样品需要在高真空条件下观察,在低真空或潮湿条件下观察则要用到可变压或环境SEM,而在低温或高温下观察时则要用到专门的仪器。[1]
目录编辑
- 8阴极射线发光
- 9X射线显微分析
- 10SEM分辨率
- 11环境扫描电镜
- 12透射扫描电镜
- 13扫描电镜中的颜色
- 13.1 使用单检测器着色
- 13.2 SEM图的着色
- 13.3 使用多电子检测器着色
- 13.4 基于产生的光子的分析信号
- 14扫描电镜中的三维成像
- 14.1 基于立体图像对的SEM三维重构
- 14.2 基于阴影形状的四象限探测器的光度三维重构扫描电镜
- 14.3 单张SEM图的三维色彩渲染
- 14.4 其他类型的三维SEM重构
1 历史编辑
历史上,麦克马伦(McMullan)最早提出使用SEM。[2][3] 虽然马克斯·克诺尔( Max Knoll)通过使用电子束扫描仪拍摄出一张标尺为50毫米的照片来显示通道衬度,[4] 但却是曼弗雷德·冯·阿登(Manfred von Ardenne )在1937年发明了[5] 真正的用缩小的聚焦电子束扫描超细光栅的高倍显微镜。阿登利用扫描原理不仅是为了获得放大倍率,也是为了逐步消除电子显微镜固有的色差。他进一步讨论了扫描电镜的各种检测模式、可能性和理论,[6] 并致力于建造 第一台高分辨扫描电子显微镜(first high-magnification SEM)。[7] 兹沃里金( Zworykin)小组开展了进一步的工作,[8] 紧接着是20世纪50年代和60年代初的剑桥大学(Cambridge)小组[9][10][11][12] 1965年,以查尔斯·奥特莱( Charles Oatley)为首的剑桥科学仪器公司( Cambridge Scientific Instrument Company)将第一台商用仪器“立式扫描仪(Stereoscan)”推向市场,并交付给杜邦公司(DuPont)。
2 原理与性能编辑
扫描电子显微镜(SEM)中用来产生图像的信号源于电子束与样品中不同深度的原子相互作用。因此而产生各种类型的信号包括二次电子(Secondary electron, SE)、反射或背散射电子(Back-scattered electron, BSE)、特征X射线和光线(阴极射线发光)(CL)、吸收电流(样品电流)和透射电子。 二次电子探测器是所有扫描电镜的标配。
在二次电子成像(Secondary electron imaging, SEI)中,二次电子是从样品表层发射的。因此,SEI可以产生超高分辨率的样品表面图像并显示尺寸小于1纳米的细节。背散射电子(BSE)是通过弹性散射从样品反射的成束电子。它们的发射位置在样品更深处,因此BSE图像的分辨率低于SE。然而,BSE与从特征性X射线获得的光谱通常用于分析型SEM,因为BSE信号的强度与样品的原子序数(Z)密切相关。BSE图像可以提供样本中不同元素的分布信息,但不能提供结构信息。 在主要由轻元素组成的样本中,例如生物样本,BSE成像可以对直径为5-10 nm的胶态金免疫标记成像,而这很难或不可能利用二次电子成像检测到。 当电子束从样品中激发出内壳层电子时,样品会发射出特征X射线,这是因为高能电子充满壳层并释放能量。这些特征X射线的能量或波长可以通过能谱仪(Energy-dispersive X-ray spectroscopy, EDX)或波谱仪(Wavelength-dispersive X-ray spectroscopy)测量,并可用于识别和测量样品中的元素丰度进而绘制元素分布图。
由于电子束直径非常小,SEM照片具有很大的景深,这就形成了有助于理解样品表面结构的特征性三维外观。 上面显示的花粉显微照片就是证明。SEM的放大范围很广,从大约10倍(大约相当于一个强大的手磨透镜)到超过50万倍,大约是最好的光学显微镜的放大极限的250倍。
3 样品制备编辑
由于样品台的限制,SEM样品必须足够小,同时可能需要特殊的预处理来增加样品的电导率和稳定性,以便样品能够承受高真空条件和高能电子束的轰击。通常使用导电胶将样品牢固地安装在样品台或短柱上。SEM被广泛用于半导体晶片的缺陷分析,制造商制造出可以检查尺寸为300 mm的半导体晶片的任何部位的仪器。许多仪器都有着可以将该尺寸的物体倾斜45°并提供连续360°旋转的腔室。
非导电样品在被电子束扫过时会有电荷富集,特别是在二次电子成像模式下,这会导致扫描故障和其他图片失真。在SEM中的常规成像中,样品必须导电,至少表面是导电的,并且样品要电接地,以防止静电电荷的累积。除了做好清洁和安装到样品台上时保证导电,金属物体几乎不需要为SEM做特殊的预处理。 非导电材料通常要通过低真空溅射或高真空蒸发沉积在样品上涂覆超薄的导电材料涂层。目前用于样品的涂层导电材料有金、金/钯合金、铂、铱、钨、铬、锇[13] 和石墨。重金属涂层可能会增加低原子序数(Z)样品的信噪比。这种改进是因为高Z材料的二次电子发射得到了增强。
一些生物样品不使用导电材料涂层,而是通过使用不同的OTO染色方法(四氧化锇、硫代碳酰肼、锇)浸渍锇来增加材料的整体电导率。[13][14]
环境扫描电镜(Environmental SEM, ESEM)或扫描电镜的低压操作模式可以用于对不含涂层的非导电样品进行成像。[15] 在ESEM中,样品被放置在相对高压的腔室中,电子光学柱借助差动泵送入腔体以保持电子枪的真空度适当低。样品周围的高压区域中和了电荷,并放大了二次电子信号。低压扫描电子显微镜通常在具有场发射枪(Field-emission gun, FEG)的仪器中进行,场发射枪即使在低加速电压下也能产生高能一次电子和小尺寸光斑。为防止对非导电样品充电,必须调整工作条件,使入射束电流等于出射二次电子电流和背散射电子电流之和,最常见的工作条件加速电压为0.3-4千伏时。
当原始样品因方法限制或法律问题不适合或者不能用于扫描电镜检查时,可以人工合成复制品以避免使用原始样品。该技术分为两步: 一是使用硅基牙科弹性体制造出原始表面的模具,二是通过将合成树脂倒入模具以获得表面复型。[16]
当用背散射电子中成像或进行特征X射线显微分析时,可以将生物和材料样品嵌入树脂再抛光至镜面。
环境扫描电镜无需以下概述的大多制备技术,但是一些生物样品可以在固定时受益。
3.1 生物样品
扫描电镜的样品,通常要求样品完全干燥,因为样品室处于高真空状态。坚硬、干燥的材料,如木头、骨头、羽毛、干燥的昆虫或贝壳(包括蛋壳[17])在检测时所需的进一步处理很少,但是活细胞和组织以及完整的软体生物需要化学固定来保存和稳定它们的结构。
固定通常首先是将样品浸泡在含有化学固定剂(例如戊二醛,有时与甲醛结合)[18][19][20]和其他固定剂 [21]的缓冲溶液中,可能还有一步用四氧化锇固定。[18] 接下来就是将固定好的组织脱水。由于空气干燥会导致生物样品塌陷和收缩,所以通常采用有机溶剂(如乙醇或丙酮)置换细胞中的水,再临界干燥流体(如液态二氧化碳)置换这些溶剂来实现固定。[22] 二氧化碳最终在超临界状态下被去除,因此在干燥过程中样品中不存在气液界面。
干燥样品一般用粘合剂(如环氧树脂或导电双面胶带)固定在样品台上,并在用显微镜检测前溅射金或金/钯合金。如果要对生物体内部的超微结构进行成像,可以对样品进行切片(用切片机)。
如果扫描电镜装备有低温显微镜的冷冻样品台,可以使用冷冻固定,并用低温扫描电子显微镜对冷冻固定的样品进行检测。[18] 冷冻固定的样品可以在真空下在特殊设备中冷冻断裂,以揭示内部结构,在保持冷冻状态的同时溅射涂层并将其转移到扫描电镜冷冻台上[23] 低温扫描电子显微镜也适用于对温度敏感的材料如冰[24][25] 和脂肪的成像。[26]
冷冻破碎、冷冻蚀刻或冷冻再破碎是一种特别适用于正面观察类脂膜及其掺杂的蛋白质的制备方法。该制备方法揭示了嵌入在磷脂双分子层的蛋白质。
3.2 材料
样品的背散射电子成像、特征X射线分析和X射线成像通常需要将样品研磨和抛光表面至超光滑表面。经过WDS或能谱分析的样品通常包覆有碳。一般来说,金属在扫描电镜成像之前不会涂覆涂层,因为它们导电而且提供了它们自己的接地路径。
断面分析是对断裂表面的研究,可以在光学显微镜上进行,或通常在扫描电镜上进行。首先是将断裂表面切割成合适的尺寸,并清除其他有机残留物最后将其安装在样品架上,以便用扫描电镜观察。
集成电路可以用聚焦离子束(FIB) 或其他离子束铣削仪器切割,以便在扫描电镜中观察。第一种情况下可以将扫描电镜与FIB结合。
金属、地质样品和集成电路都可以进行化学抛光,以便在扫描电镜中观察。
无机薄膜的高倍成像需要特殊的高分辨率涂层技术。
4 扫描与成像过程编辑
在典型的扫描电镜中,电子束是由装有钨丝阴极的电子枪热发射的。钨通常用于热离子电子枪,因为它具有所有金属中最高的熔点和最低的蒸汽压以及低成本,因此它可以通过电加热来发射电子。其他类型的电子枪有硼化镧(LaB6)阴极枪(如果真空系统升级,可以用在标准钨丝扫描电子显微镜中),场发射枪(FEG)(可以使用钨单晶发射器作冷阴极)或氧化锆枪(热辅助肖特基型)。
电子束的能量范围通常在0.2 kev到40 kev之间,电子束经由一个或两个聚光透镜聚焦成直径约0.4 nm至5 nm的光斑。电子束通过电子柱中的成对扫描线圈或成对偏转板(通常是在最终透镜组中将光束偏转到 x轴 和y 轴上,以便它以光栅的方式扫描样品表面的矩形区域。
当一次电子束与样品相互作用时,电子在样品的泪滴状区域(距离表面100 nm至5 μm)内通过重复的随机散射和吸收损失能量。相互作用区域的大小取决于电子的着陆能量、样品的原子序数和样品的密度。电子束和样品之间的能量交换包括弹性散射导致的高能电子的反射、非弹性散射导致的二次电子发射和电磁辐射,每一种信号都可以被专门的探测器探测到。样品所吸收的电流也可以被检测到,并被用于对样品电流分布成像。用于放大信号的有各种类型的电子放大器,在计算机显示器上这些信号表现出亮度变化(或者对于老型号在阴极射线管上显示)。计算机视频存储器的每个像素都与显微镜中样品上光束的位置同步,因此所得图像是从样品的扫描区域发出的信号强度的分布图。以前的显微镜可以捕捉胶片上的图像,但大多数现代仪器收集数字图像。
4.1 放大倍数
扫描电镜的放大倍数大约可以在6个数量级的范围内变化,从10倍到500000倍。与光学显微镜和透射电子显微镜不同,扫描电镜中的图像放大倍数与物镜功率无关。SEM品中可能有聚光镜和物镜,但它们的功能是将电子束聚焦在一个点上,而不是对样本成像。如果电子枪能够产生尺寸足够小的电子束,原则上扫描电镜可以完全不用聚光镜或物镜工作,尽管可能不是非常常见或无法获得非常高的分辨率。在扫描电镜中,比如在扫描探针显微镜中,放大倍数由样品上光栅的尺寸与显示设备上光栅的尺寸之比决定。假设显示屏的尺寸固定,放大倍数越高,样品上光栅的尺寸越小,反之亦然。因此,放大倍数取决于由提供给x、y扫描线圈的电流或提供给x、y偏转板的电压,而不是由物镜功率控制。
5 二次电子检测编辑
最常见的成像模式是收集低能(< 50 eV)二次电子,这些低能二次电子是通过一次电子与样品原子的非弹性散射相互作用从导带或价带发射出来的。由于能量低,这些电子源于样品表面以下几纳米的区域。[27] 采用艾弗哈特-索恩利探测器( Everhart-Thornley detector)可以探测到二次电子,[27] 这是一种收集器-闪烁器-光电倍增器的耦合系统。首先是通过偏置电压约为+400 V的栅极吸引并收集二次电子,然后在正偏压约为+2000 V的磷光体或闪烁体中对二次电子加速。加速后的二次电子现在具有足够的能量来使闪烁体发射闪光(阴极射线发光),这些闪光通过光导管和样品室壁上的窗口传导到扫描电镜柱外部的光电倍增器。光电倍增器输出的放大电信号显示为二维强度分布,可以在模拟视频显示器上观看和拍摄,或者经过模数转换并显示和保存为数字图像。这个过程取决于光栅扫描的一次电子。信号的亮度取决于到达探测器的二次电子数。如果光束垂直于表面进入样品,那么激活区域围绕光束轴呈均匀分布,并且会有一定数量的电子从样品中“逃逸”。随着入射角的增加,相互作用区域增加,光束一侧的“逃逸”距离减小,导致样品发射更多的二次电子。因此,陡峭的表面和边缘往往比平坦的表面更亮,这使得图像具有清晰的三维外观。利用二次电子信号获得分辨率小于0.5 nm图像是可能的。
6 背散射电子检测编辑
背散射电子(BSE)由一次电子产生的高能电子组成,这些高能电子通过与样品原子的弹性散射相互作用被反射或反向散射出样品相互作用区域。由于重元素(高原子序数)的背散射电子比轻元素(低原子序数)更强,因此在图像中衬度更亮,因此BSE被用于检测具有不同化学成分的区域之间的对比度。[28] 埃弗哈特-索恩利检测器通常位于样品的一侧,由于在检测器正对的立体区域中很少发射这种电子,而且由于正偏压的探测栅极几乎没有能力吸引更高能量的BSE,所以其在检测背散射电子时十分低效。背散射电子的专用探测器在样品上方呈“甜甜圈”型排列,与电子束同轴,这可以使立体收集角最大化。BSE探测器通常是闪烁体型或半导体型。当探测器的所有部分都用来收集关于电子束对称的电子时,就会产生原子序数对比。然而,通过使用不对称的定向BSE检测器从样品上方的一侧收集背散射电子,就会产生强烈的形貌对比;由此产生的对比度表现为从该侧照亮表面。半导体探测器可以做成辐射状,可以切入或切出,以控制产生的对比度类型及其方向性。
背散射电子也可用于形成背散射电子衍射(EBSD)图像,该图像可用于确定样品的晶体结构。
7 半导体的电子束注入分析编辑
扫描电子显微镜的探针——高能电子的性质使其特别适合于检查半导体材料的光学和电子特性。扫描电镜电子束中的高能电子将把载流子注入半导体。因此,电子束中的电子通过使电子受激从价带进入导带而失去能量,留下空穴。
在直接带隙材料中,这些电子-空穴对的复合将产生阴极射线发光;如果样品含有内部电场,如pn结,SEM中的载流子注入将导致电子束感应电流(EBIC)流动。 阴极射线发光和EBIC被称为“电子束注入”技术,是研究半导体光电特征的非常强大的探针,尤其是用于研究纳米级特征和缺陷。
8 阴极射线发光编辑
9 X射线显微分析编辑
因电子与样品相互作用而产生的特征性X射线也可以在配有能谱仪(EDS)或波谱仪(WDS)的SEM中检测到。X射线信号的分析可用于绘制元素分布图和估计样品中元素的丰度。
10 SEM分辨率编辑
扫描电镜不是照相机,探测器也不像CCD阵列或胶片那样连续成像。与光学系统不同,SEM分辨率不受衍射极限、透镜或反光镜的精细度或探测器阵列分辨率的限制。聚焦光学系统可以是大而粗糙的,二次电子检测器可以大如拳头,只用于检测电流。相反,扫描电镜的空间分辨率取决于电子束斑的尺寸,而电子束斑的尺寸又取决于电子的波长和产生扫描光束的电子光学系统。分辨率相互作用区域的大小、相互作用区域的样品材料的体积的限制。与原子之间的距离相比,电子束斑尺寸和相互作用区域都很大,因此扫描电镜的分辨率不足以像透射电子显微镜(TEM)那样对单个原子成像。扫描电镜具有附加的优点,比如能够对面积相对较大的样品成像;对块体材料(不仅仅是薄膜或箔)成像;以及有着可用于测量样品组成和性质的各种分析模式。受仪器影响,分辨率可能降低至1 nm和20 nm。截至2009年,世界最高分辨率的常规(≤30 千伏)扫描电镜使用二次电子检测器可以达到0.4 nm的点分辨率 。[28]
11 环境扫描电镜编辑
常规扫描电镜要求样品在真空下成像,因为气体环境会使电子束迅速扩散和衰减。因此,产生大量气体的样品,如湿生物样品或含油岩石,必须预先干燥或低温冷冻。涉及相变的过程,例如粘合剂的干燥或合金的熔化、液体输运、化学反应和固体-空气-气体系统,通常不能用常规高真空扫描电镜观察到。在环境扫描电镜(ESEM)中,腔内空气被抽离,但水蒸气保留在其饱和压力附近,腔内残余气压维持在相对较高的水平。这就可以分析含有水或其他挥发性物质的样品。在ESEM,对活的昆虫进行观察已成为可能。[29]
ESEM的第一次商业开发是在20世纪80年代末[30][31] ,当时可以在低气压和高相对湿度(高达100%)环境中观察样品(例如1-50 Torr或0.1-6.7 kPa)。这一切因二次电子探测器的发展和通过在电子束路径中设置可以将真空区域(枪和透镜周围)与样品室分开的含差动泵的限压孔而使在水蒸气的存在的情况下操作成为可能[32][33] 。1988年,美国电子扫描公司(ElectroScan Corporation)生产了第一台商用ESEM。1996年,飞利浦( Philips)将其收购(后来将电子光学部门出售给FEI公司)。[34]
由于不必涂覆碳或金层,ESEM对于非金属和生物材料作用巨大。未涂覆的塑料和弹性体可以进行常规检测,未涂覆的生物样品同样可以。这一点十分有用,因为涂层可能难以逆转,可能会隐藏样品表面的小特征,并可能降低所得结果的价值。由于重金属涂层不利于X射线分析,因此常规SEM通常采用碳涂层,但ESEM使未涂覆涂层的非导电样品进行X射线微分析成为可能;然而,在X射线分析中引入了一些特定的ESEM假象。对用于刑事或民事诉讼的特殊样品来说,可能更偏向于采用ESEM,在这种情况下,法医分析可能需要由几个不同的专家重复进行。用ESEM或其他液相电子显微镜方法研究液体中的样品成为可能。[35]
12 透射扫描电镜编辑
只需在薄样品部分下面安装一个合适的检测器,扫描电子显微镜也可以在透射模式下使用。[36] 目前报道的明暗场成像通常都是在扫描电镜中利用较低的电子加速电压内进行,这增加了未染色生物样品用场发射电子枪在高倍下成像的对比度。这种操作模式简写为tSEM。
13 扫描电镜中的颜色编辑
电子显微镜无法直接形成彩色图像,因为扫描电镜每个像素产生单一值;该值对应于当电子束指向的(x, y)像素位置。
对单个像素而言,这个单一的数字通常用灰度值表示,形成“黑白”图像。[37] 然而,目前有几种方法可以用于彩色电子显微镜成像。[38]
13.1 使用单检测器着色
- 在平面的组成图像上(以BSE为代表):
获取颜色最简单的方法是使用一个颜色查找表将任意颜色与这个数字关联起来(即每个灰度值都用一个特定的颜色替换)。这种方法被称为伪色法。在BSE图中,可以使用伪色来更好地区分样品的不同区域。
- 在带有纹理的表面图像上:
除了简单地用颜色替换每个灰度值之外,借助倾斜电子束观察的样品使研究人员可以获得形如地貌的图像(参见“单张SEM图的三维灯光渲染”一节)。这样的形貌随后可以用3D渲染算法进行处理,以便更自然地渲染表面纹理
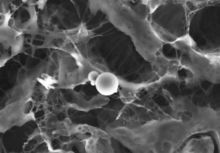
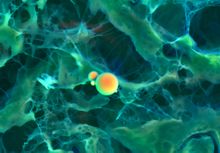
肾结石表面图
根据所测形貌重新着色后的同一图片
成岩蚀变盘状体的SEM图
经过相似着色后的同一图像
13.2 SEM图的着色
一般公开的SEM图都是人工着色的。 这样做可能是为了美观,阐明结构或给样品增加逼真的外观[39] 并且通常不引入与样品有关的信息。[40]
着色可以通过照片编辑软件手动执行,或者利用特征检测或面向对象分割的专用软件半自动执行。[41]
玉米芯花粉的SEM图
半自动着色后的同一图片。其余颜色有助于识别结构的各种元素
紫露草花粉和雄蕊的彩色SEM图
13.3 使用多电子检测器着色
一些设备通常使用多个检测器,以便在每个像素上收集到更多的信息。[42]
常见的是将二次电子和背散射电子检测器相叠加,并且每个检测器捕获的每个图像都被分配一种颜色,[43][44] 其中颜色与组分密度相关。这种方法被称为密度关联的彩色扫描电镜(DDC-SEM)。由此形成的显微照片保留了被二次电子探测器更好地捕获的形貌信息,并与背散射电子探测器获得的密度信息结合。[45][46]
心脏组织中钙化颗粒的DDC-SEM图-信号1:二次电子图
信号2:背散射电子图
根据前两张图中绘制的彩色图像。心血管钙化颗粒的密度依赖性彩色扫描电镜(DDC-SEM),橙色显示磷酸钙球形颗粒(致密材料),绿色显示细胞外基质(致密材料)。
同一工作的更高倍放大图,这是人类心血管组织钙化组织研究的一部分
13.4 基于产生的光子的分析信号
测量从样品发射的光子的能量是获得分析功能的常用方法。例如,用于元素分析的能谱仪(EDS)和用于分析地质样品中电子诱导发光的强度和光谱的阴极射线发光(CL)显微镜系统。 在使用这些检测器的SEM系统中,一般对这些额外的信号进行颜色编码,并将它们叠加在单一的彩色图像中,以便可以清楚地看到和比较样品中不同成分的分布差异。也可以通过标准二次电子图像与一个或多个组成通道合并,以便可以比较样品的结构和组成。这类图像可以在保持原始信号数据的全部保留的同时形成,而原始信号数据不会以任何方式被修改。
14 扫描电镜中的三维成像编辑
SEM并不能直接提供与SEM信号相反的三维图像。然而,SEM可以采用以下不同方法获得3维信息。
14.1 基于立体图像对的SEM三维重构
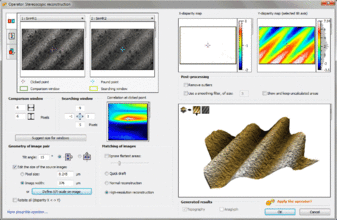
- 摄影测量是向SEM图像中引入三维信息的最精确的计量方法。[47] 与测光方法(下一节)相反,摄影测量是使用三角测量方法计算绝对高度。其缺点是它只有在纹理足够小的情况下才起作用,并且它需要从两个不同的角度采集两幅图像,这就要用到倾斜平台。(摄影测量是一种软件操作,计算同一对图像中的左图像和右图像之间每个像素的偏移(或“视差”)。这种偏移反映了当前位置的高度)。
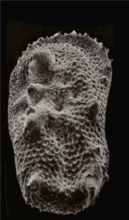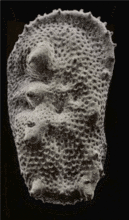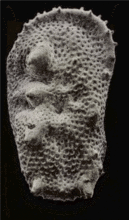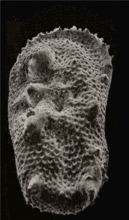
通过沿纵轴倾斜获得的一对尺寸小于1 mm的显微化石(介形亚纲)
根据这对SEM图通过摄影测量法(使用Mountainsmap软件,见下一幅图像)重建了三维结构;然后制作了一系列不同角度的三维展示,并将其输出为一个GIF文件制作出该动画。
采用倾斜15°的2张SEM图像(左上角)对粗糙度(Ra=3 μm)校准样品(用于校准轮廓仪)进行三维表面重建。三维模型(右下角)的计算时间约为1.5秒,计算出的Ra粗糙度误差小于0.5%
14.2 基于阴影形状的四象限探测器的光度三维重构扫描电镜
这种方法通常使用四象限BSE检测器(另一种方法是一个制造商使用三段检测器)。显微镜同时产生同一样本的四幅图像,因此不需要倾斜样品。该方法给出了测量的三维尺寸,只要样品的斜率保持合理。[47] 大多数扫描电镜制造商现在(2018年)提供这种内置或可选的四象限BSE检测器,以及允许实时计算3D图像的专有软件。[47]
其他方法使用更复杂(有时是GPU密集型)的方法,如最佳估计算法,并提供更好的结果[48] 代价是对计算能力的高要求。
无论在哪种情况下,这种方法都是通过整合坡度来实现的,因此垂直坡度和悬高被忽略;比如,如果一个完整的球体位于一个平面上,可以看到在平面上方出现的上半球略多一点,导致球体顶点的高度错误。这种效应的显著性取决于BSE探测器相对于样品的角度,但这些探测器通常位于电子束周围(并靠近电子束),因此这种效应非常普遍。
14.3 单张SEM图的三维色彩渲染
这种方法需要在倾斜的低角度照明下获得扫描电镜图像。然后,灰度值被解释为斜率,斜率被整合以恢复样品形貌。这种方法对于视觉增强和物体形状和位置的检测很有意思;然而,垂直高度通常无法校准,这与摄影测量等其他方法相反。[47]
放大倍数为450倍的苍蝇复眼表面的SEM图。
前一张图片的细节
采用来自着色算法的形状功能对前面的SEM照片进行三维重建。
与前一张照片相同,但在应用着色算法中的形状之前,灯光已均匀化
14.4 其他类型的三维SEM重构
- 使用单个2D文件的多分辨率重建:高质量的3D成像可能是揭示所有多孔介质复杂性的最终解决方案,但是获取高质量的3D图像既昂贵又耗时。另一方面,高质量的2D扫描电镜图像随处可见。近年来,人们提出了一种全新的三步骤、多尺度、多分辨率的直接使用2D图像来建立3D模型重构方法。该方法基于信息熵(Shannon Entropy)和条件模拟,可用于大多数可用的静态材料,并且仅使用几个薄截面即可构建各种随机3D模型。[52][53][54]
14.5 三维SEM的应用
一个可能的应用是测量冰晶的粗糙度。这种方法可以结合可变压环境扫描电镜和扫描电镜的3D功能来测量单个冰晶面上的粗糙度,将其转换成计算机模型,再对模型进行进一步的统计分析。[55] 其他测量包括分形维数、检测金属断裂表面、材料表征、腐蚀测量和纳米尺度的尺寸测量(台阶高度、体积、角度、平面度、承载比、共面性等)中。
15 扫描电镜图像库编辑
以下是采用扫描电镜拍摄的图像示例。
大豆胞囊线虫和卵的彩色SEM图。人工着色使图像更容易让非专家人员阅读和理解SEM照片中显示的结构和表面。
南极磷虾的复眼。由于SEM照片可以获得景深,节肢动物的眼睛成为SEM显微照片的一个常见主题。着色后的图片。
南极磷虾复眼,放大数较高。SEM的放大倍数可以覆盖光学显微镜到透射电镜。着色后的图片。
正常循环血液的SEM图。这是一张较早由常规SEM拍摄的低分辨率显微照片:红血球。
密歇根泥盆纪(Devonian of Michigan)(最大管直径为0.75 mm)一种河豚的SEM图。SEM被广泛用于捕捉微观和宏观化石的图像细节。
古代玻璃碎片中富锑区的背散射电子(BSE)图。博物馆采用SEM以无损的方式研究有价值的文物。
古代玻璃碎片表面腐蚀层的SEM图;注意腐蚀层的层状结构。
在场发射扫描电镜上拍摄的用于半导体制造的光致抗蚀剂层的SEM图。这类SEM因其高分辨率而在半导体工业中占有重要地位。
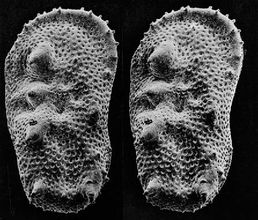
呈现出从结石无定形的中心部分出现的威德莱特(草酸钙二水合物)的四方晶体的肾结石表面的SEM图。图片的水平长度代表数字原件的0.5 mm。
通过光学显微镜(左)和SEM(右)观察到的同一深度雪晶的两个幅图像。请注意,SEM图像能够清晰地感知光学显微镜图像中难以完全辨认的精细结构细节。
洋葱片内表面的表皮细胞。在沙绿色的细胞壁下面,我们可以看到细胞核和小的细胞器漂浮在细胞质中。这幅经镧系元素染色的BSE图像是在没有预先固定、没有脱水、也没有溅射的情况下拍摄的。
叶片下表面气孔的SEM图。
参考文献
- [1]
^Stokes, Debbie J. (2008). Principles and Practice of Variable Pressure Environmental Scanning Electron Microscopy (VP-ESEM). Chichester: John Wiley & Sons. ISBN 978-0470758748..
- [2]
^McMullan, D. (2006). "Scanning electron microscopy 1928–1965". Scanning. 17 (3): 175–185. doi:10.1002/sca.4950170309. PMC 2496789..
- [3]
^McMullan, D. (1988). "Von Ardenne and the scanning electron microscope". Proc Roy Microsc Soc. 23: 283–288..
- [4]
^Knoll, Max (1935). "Aufladepotentiel und Sekundäremission elektronenbestrahlter Körper". Zeitschrift für Technische Physik. 16: 467–475..
- [5]
^von Ardenne M. Improvements in electron microscopes. GB 511204, convention date (Germany) 18 February 1937.
- [6]
^von Ardenne, Manfred (1938). "Das Elektronen-Rastermikroskop. Theoretische Grundlagen". Zeitschrift für Physik (in German). 109 (9–10): 553–572. Bibcode:1938ZPhy..109..553V. doi:10.1007/BF01341584.CS1 maint: Unrecognized language (link).
- [7]
^von Ardenne, Manfred (1938). "Das Elektronen-Rastermikroskop. Praktische Ausführung". Zeitschrift für Technische Physik (in German). 19: 407–416.CS1 maint: Unrecognized language (link).
- [8]
^Zworykin VA, Hillier J, Snyder RL (1942) A scanning electron microscope. ASTM Bull 117, 15–23..
- [9]
^McMullan, D. (1953). "An improved scanning electron microscope for opaque specimens". Proceedings of the IEE – Part II: Power Engineering. 100 (75): 245–256. doi:10.1049/pi-2.1953.0095..
- [10]
^Oatley CW, Nixon WC, Pease RFW (1965) Scanning electron microscopy. Adv Electronics Electron Phys 21, 181–247..
- [11]
^Smith KCA, Oatley, CW (1955). "The scanning electron microscope and its fields of application". British Journal of Applied Physics. 6 (11): 391–399. Bibcode:1955BJAP....6..391S. doi:10.1088/0508-3443/6/11/304.CS1 maint: Multiple names: authors list (link).
- [12]
^Wells OC (1957) The construction of a scanning electron microscope and its application to the study of fibres. PhD Dissertation, Cambridge University..
- [13]
^Suzuki, E. (2002). "High-resolution scanning electron microscopy of immunogold-labelled cells by the use of thin plasma coating of osmium". Journal of Microscopy. 208 (3): 153–157. doi:10.1046/j.1365-2818.2002.01082.x..
- [14]
^Malick, Linda E.; Wilson, Richard B.; Stetson, David (1975). "Modified Thiocarbohydrazide Procedure for Scanning Electron Microscopy: Routine use for Normal, Pathological, or Experimental Tissues". Biotechnic & Histochemistry. 50 (4): 265–269. doi:10.3109/10520297509117069..
- [15]
^Hortolà, Policarp (2005). "SEM Examination of Human Erythrocytes in Uncoated Bloodstains on Stone: Use of Conventional as Environmental-like SEM in a Soft Biological Tissue (and Hard Inorganic Material)". Journal of Microscopy. 218 (2): 94–103. doi:10.1111/j.1365-2818.2005.01477.x. PMID 15857371..
- [16]
^Hortolà, Policarp (2015). "Evaluating the Use of Synthetic Replicas for SEM Identification of Bloodstains (with Emphasis on Archaeological and Ethnographic Artifacts)". Microscopy and Microanalysis. 21 (6): 1504–1513. Bibcode:2015MiMic..21.1504H. doi:10.1017/S1431927615014920. PMID 26522368..
- [17]
^Conrad, Cyler; Jones, Emily Lena; Newsome, Seth D.; Schwartz, Douglas W. (2016). "Bone isotopes, eggshell and turkey husbandry at Arroyo Hondo Pueblo". Journal of Archaeological Science: Reports. 10: 566–574. doi:10.1016/j.jasrep.2016.06.016..
- [18]
^Jeffree, C. E.; Read, N. D. (1991). "Ambient- and Low-temperature scanning electron microscopy". In Hall, J. L.; Hawes, C. R. Electron Microscopy of Plant Cells. London: Academic Press. pp. 313–413. ISBN 978-0-12-318880-9..
- [19]
^Karnovsky, M. J. (1965). "A formaldehyde-glutaraldehyde fixative of high osmolality for use in electron microscopy" (PDF). Journal of Cell Biology. 27 (2): 1A–149A. JSTOR 1604673..
- [20]
^Kiernan, J. A. (2000). "Formaldehyde, formalin, paraformaldehyde and glutaraldehyde: What they are and what they do". Microscopy Today. 2000 (1): 8–12. doi:10.1017/S1551929500057060..
- [21]
^Russell, S. D.; Daghlian, C. P. (1985). "Scanning electron microscopic observations on deembedded biological tissue sections: Comparison of different fixatives and embedding materials". Journal of Electron Microscopy Technique. 2 (5): 489–495. doi:10.1002/jemt.1060020511..
- [22]
^Chandler, Douglas E.; Roberson, Robert W. (2009). Bioimaging : current concepts in light and electron microscopy. Sudbury, Mass.: Jones and Bartlett Publishers. ISBN 9780763738747..
- [23]
^Faulkner, Christine; et al. (2008). "Peeking into Pit Fields: A Multiple Twinning Model of Secondary Plasmodesmata Formation in Tobacco". Plant Cell. 20 (6): 1504–18. doi:10.1105/tpc.107.056903. PMC 2483367. PMID 18667640..
- [24]
^Wergin, W. P.; Erbe, E. F. (1994). "Snow crystals: capturing snow flakes for observation with the low-temperature scanning electron microscope". Scanning. 16 (Suppl. IV): IV88..
- [25]
^Barnes, P. R. F.; Mulvaney, R.; Wolff, E. W.; Robinson, K. A. (2002). "A technique for the examination of polar ice using the scanning electron microscope". Journal of Microscopy. 205 (2): 118–124. doi:10.1046/j.0022-2720.2001.00981.x. PMID 11879426..
- [26]
^Hindmarsh, J. P.; Russell, A. B.; Chen, X. D. (2007). "Fundamentals of the spray freezing of foods—microstructure of frozen droplets". Journal of Food Engineering. 78 (1): 136–150. doi:10.1016/j.jfoodeng.2005.09.011..
- [27]
^Everhart, T. E.; Thornley, R. F. M. (1960). "Wide-band detector for micro-microampere low-energy electron currents" (PDF). Journal of Scientific Instruments. 37 (7): 246–248. Bibcode:1960JScI...37..246E. doi:10.1088/0950-7671/37/7/307..
- [28]
^Goldstein, G. I.; Newbury, D. E.; Echlin, P.; Joy, D. C.; Fiori, C.; Lifshin, E. (1981). Scanning electron microscopy and x-ray microanalysis. New York: Plenum Press. ISBN 978-0-306-40768-0..
- [29]
^Takaku, Yasuharu; Suzuki, Hiroshi; Ohta, Isao; Tsutsui, Takami; Matsumoto, Haruko; Shimomura, Masatsugu; Hariyama, Takahiko (7 March 2015). "A 'NanoSuit' surface shield successfully protects organisms in high vacuum: observations on living organisms in an FE-SEM". Proceedings of the Royal Society of London B: Biological Sciences (in 英语). 282 (1802): 20142857. doi:10.1098/rspb.2014.2857. ISSN 0962-8452. PMC 4344158. PMID 25631998..
- [30]
^Danilatos, G. D. (1988). "Foundations of environmental scanning electron microscopy". Advances in Electronics and Electron Physics Volume 71. Advances in Electronics and Electron Physics. 71. pp. 109–250. doi:10.1016/S0065-2539(08)60902-6. ISBN 9780120146710..
- [31]
^US4,823,006 (PDF 版本) (于{{{y}}}年{{{m}}}月{{{d}}}日注册) Danilatos, Gerasimos D. and Lewis, George C.——Integrated electron optical/differential pumping/imaging signal detection system for an environmental scanning electron microscope。.
- [32]
^Danilatos, G. D. (1990). Theory of the Gaseous Detector Device in the ESEM. Advances in Electronics and Electron Physics. 78. pp. 1–102. doi:10.1016/S0065-2539(08)60388-1. ISBN 9780120146789..
- [33]
^US4,785,182 (PDF 版本) (于{{{y}}}年{{{m}}}月{{{d}}}日注册) Mancuso, James F.; Maxwell, William B. and Danilatos, Gerasimos D.——Secondary Electron Detector for Use in a Gaseous Atmosphere。.
- [34]
^History of Electron Microscopy 1990s. sfc.fr.
- [35]
^de Jonge, N.; Ross, F.M. (2011). "Electron microscopy of specimens in liquid". Nature Nanotechnology. 6 (8): 695–704. Bibcode:2003NatMa...2..532W. doi:10.1038/nmat944. PMID 12872162..
- [36]
^Klein, Tobias; Buhr, Egbert; Frase, Carl G. (2012). TSEM: A Review of Scanning Electron Microscopy in Transmission Mode and Its Applications. Advances in Imaging and Electron Physics. 171. pp. 297–356. doi:10.1016/B978-0-12-394297-5.00006-4. ISBN 9780123942975..
- [37]
^Burgess, Jeremy (1987). Under the Microscope: A Hidden World Revealed. CUP Archive. p. 11. ISBN 978-0521399401..
- [38]
^Showing your true colors, 3D and color in electron microscopy in Lab News magazine.
- [39]
^Hortolà, P. (2010). "Using digital color to increase the realistic appearance of SEM micrographs of bloodstains". Micron. 41 (7): 904–908. doi:10.1016/j.micron.2010.06.010. PMID 20638857..
- [40]
^"Introduction to Electron Microscopy" (PDF). FEI Company. p. 15. Retrieved 12 December 2012..
- [41]
^"Next Monday, Digital Surf to Launch Revolutionary SEM Image Colorization". AZO Materials. 2016-01-22. Retrieved 23 January 2016..
- [42]
^Antonovsky, A. (1984). "The application of colour to SEM imaging for increased definition". Micron and Microscopica Acta. 15 (2): 77–84. doi:10.1016/0739-6260(84)90005-4..
- [43]
^Danilatos, G.D. (1986). "Colour micrographs for backscattered electron signals in the SEM". Scanning. 9 (3): 8–18. doi:10.1111/j.1365-2818.1986.tb04287.x..
- [44]
^Danilatos, G.D. (1986). "Environmental scanning electron microscopy in colour". Journal of Microscopy. 142: 317–325. doi:10.1002/sca.4950080104..
- [45]
^Bertazzo, S.; Gentleman, E.; Cloyd, K. L.; Chester, A. H.; Yacoub, M. H.; Stevens, M. M. (2013). "Nano-analytical electron microscopy reveals fundamental insights into human cardiovascular tissue calcification". Nature Materials. 12 (6): 576–583. Bibcode:2013NatMa..12..576B. doi:10.1038/nmat3627. hdl:10044/1/21901. PMC 5833942. PMID 23603848..
- [46]
^Bertazzo, Sergio; Maidment, Susannah C. R.; Kallepitis, Charalambos; Fearn, Sarah; Stevens, Molly M.; Xie, Hai-nan (9 June 2015). "Fibres and cellular structures preserved in 75-million–year-old dinosaur specimens". Nature Communications. 6: 7352. Bibcode:2015NatCo...6E7352B. doi:10.1038/ncomms8352. PMC 4468865. PMID 26056764..
- [47]
^Mignot, Christophe (2018). "Color (and 3D) for Scanning Electron Microscopy". Microscopy Today. 26 (3): 12–17. doi:10.1017/S1551929518000482..
- [48]
^Butterfield, Nicholas; Rowe, Penny M.; Stewart, Emily; Roesel, David; Neshyba, Steven (16 March 2017). "Quantitative three-dimensional ice roughness from scanning electron microscopy". Journal of Geophysical Research: Atmospheres. 122 (5): 3025–3041. Bibcode:2017JGRD..122.3023B. doi:10.1002/2016JD026094..
- [49]
^Baghaei Rad, Leili (2007). "Computational Scanning Electron Microscopy". International Conference on Frontiers of Characterization and Metrology..
- [50]
^Baghaei Rad, Leili; Downes, Ian; Ye, Jun; Adler, David; Pease, R. Fabian W. (2007). "Economic approximate models for backscattered electrons". Journal of Vacuum Science and Technology. 25 (6): 2425. Bibcode:2007JVSTB..25.2425B. doi:10.1116/1.2794068..
- [51]
^Hortolà, Policarp (2010). "Generating 3D and 3D-like animations of strongly uneven surface microareas of bloodstains from small series of partially out-of-focus digital SEM micrographs". Micron. 41 (1): 1–6. doi:10.1016/j.micron.2009.04.012. PMID 19631553..
- [52]
^Tahmasebi, Pejman; Javadpour, Farzam; Sahimi, Muhammad (2015). "Multiscale and multiresolution modeling of shales and their flow and morphological properties". Scientific Reports. 5: 16373. Bibcode:2015NatSR...516373T. doi:10.1038/srep16373. PMC 4642334. PMID 26560178..
- [53]
^Tahmasebi, Pejman; Javadpour, Farzam; Sahimi, Muhammad (2015). "Three-Dimensional Stochastic Characterization of Shale SEM Images". Transport in Porous Media. 110 (3): 521–531. doi:10.1007/s11242-015-0570-1..
- [54]
^Tahmasebi, Pejman; Sahimi, Muhammad (2012). "Reconstruction of three-dimensional porous media using a single thin section". Physical Review E. 85 (6): 066709. Bibcode:2012PhRvE..85f6709T. doi:10.1103/PhysRevE.85.066709. PMID 23005245..
- [55]
^Butterfield, Nicholas; Rowe, Penny M.; Stewart, Emily; Roesel, David; Neshyba, Steven (16 March 2017). "Quantitative three-dimensional ice roughness from scanning electron microscopy". Journal of Geophysical Research: Atmospheres. 122 (5): 3023–3041. Bibcode:2017JGRD..122.3023B. doi:10.1002/2016JD026094..
暂无