富勒烯
编辑富勒烯(Fullerene)是碳的同素异形体,其分子由通过单键和双键连接的碳原子组成,从而形成封闭或部分封闭的、有五到七元稠环的网状结构。分子可以是空心球、椭球体、管或许多其他形状和尺寸。 石墨烯(石墨的孤立原子层),是一种规则六边形环的平网格,可以被视为该家族的一个极端成员。
具有闭合网状拓扑的富勒烯非正式地由它们的经验式Cn,表示,通常写为Cn,其中n 是碳原子的数量。 然而,对于某些 n 值可能具有不止一种异构体。
富勒烯家族以巴克明斯特·富勒烯(C60 )这个家族中最著名的成员命名,而C60 是以巴克敏斯特·富勒(Buckminster Fuller)命名的。 封闭富勒烯,特别是C60 ,也被非正式地称为布基球(buckyballs),因为它们的形状明显地与标准英式足球相似。嵌套的封闭富勒烯被命名为布基洋葱(bucky onions)。圆柱形富勒烯也被称为碳纳米管或布基管(buckytubes)。 整块的纯或混合的富勒烯被称为“富勒体”(fullerite)。
富勒烯已经被预测了一段时间,但直到1985年它们意外合成后,才在自然界 和外太空中被发现。富勒烯的发现极大地增加了已知的碳同素异形体的数量,以前碳同素异形体仅限于石墨、钻石和无定形碳,如烟灰和木炭。无论是化学还是技术应用,特别是在材料科学、电子和纳米技术领域,它们都是被热门研究的主题。[1]
目录编辑
1 历史编辑
1.1 预测和有限的观察
二十面体 C60H60 笼在1965年被认为是一种可能的拓扑结构。[2] 目前在丰桥技术科学大学的大泽映二曾经预言 C60的存在。1970年[3][4] ,他注意到珊瑚蓝分子的结构是足球形状的一个子集,并假设一个完整的球形也可能存在。日本科学杂志报道了他的想法,但无论是这个著作或是其任何翻译文本都没有传播到欧美学界。
同样在1970年,R. W .汉森(当时就职于英国原子能研究机构)提出了 C60 构造并制作了一个模型。不幸的是,在当时,这种新形式碳的证据非常薄弱,因此该提议遭到了质疑,并且从未公布。 直到1999年才得到承认。[5][6]
1973年,苏联的一组科学家独立于汉森,对 C60 的稳定性进行了量子化学分析并计算了它的电子结构。这篇论文发表于1973年,[7] 但是科学界并不太重视这个理论预测。
大约在1980年,饭岛澄男从炭黑的电子显微镜图像中识别出C60 分子,在那里它形成了具有“布基洋葱”结构的粒子核心。[8]
1.2 C60 的发现
1985年,苏塞克斯大学的哈罗德·克罗托与莱斯大学的詹姆斯·希思、肖恩·奥布赖恩、罗伯特·柯尔和理查德·斯莫利合作,在氦气氛中气化碳产生的煤烟残留物中发现了富勒烯。 在产物的质谱中,出现了对应于精确质量为60或70或更多碳原子的分子的离散峰,即 C60 和 C70。该团队将他们的结构确定为现在熟悉的“布基球”。
“巴克明斯特富勒烯”这个名称最终被发现者选为C60 的名称,以此向美国建筑师巴克敏斯特·富勒致敬,因为其结构与他推广的测地线圆顶模糊相似;如果将它们扩展到一个完整的球面,则也有二十面体对称群。[9] 选择“烯”结尾是为了表明碳是不饱和的,只与另外三个原子相连,而不是正常的四个原子。 简称“富勒烯”最终适用于整个家庭。
克鲁托和斯马利获得了1996年诺贝尔化学奖[10] ,以奖励他们在发现这类分子中的作用。
1.3 进一步发展
克罗托和赖斯团队已经发现了除C60 以外的其他富勒烯, 在接下来的几年里,这个名单扩大了很多。 碳纳米管最早于1991年被发现并合成。[11][12]
这一发现后,他们发现微小数量的富勒烯在煤烟和大气中的闪电放电中生成。[13] 1992年,他们在俄罗斯的卡莱利亚一个名为shungites的矿物家族中发现了富勒烯[13]。
许多科学家改进了生产技术,包括唐纳德·霍夫曼、沃尔夫冈·克尔奇默、洛厄尔·兰姆和康斯坦丁诺斯·福斯蒂罗普洛斯。由于他们的努力,到1990年,生产克量级的富勒烯粉末样品相对容易。富勒烯纯化仍然是化学家面临的挑战,并且在很大程度上决定了富勒烯的价格。
2010年,美国国家航空航天局的斯皮策·红外望远镜在6500光年外一颗恒星周围的宇宙尘云中观察到C60 和C70 的光谱特征。[13] 克鲁托评论道:“这一最令人兴奋的突破提供了令人信服的证据,证明布基球,正如我长期以来怀疑的那样,自古以来就存在于银河系的黑暗深处。”[13] 根据天文学家莱蒂齐亚·斯坦格里尼的说法,“有可能来自外太空的布基球为地球上的生命提供了种子。”[13] 2019年,哈勃太空望远镜在这些恒星之间的空间中检测到电离的C60 分子。[14][15]
2 类型编辑
富勒烯有两大家族,具有相当不同的性质和用途:封闭的布基球和开放的圆柱形碳纳米管。 然而,这两类之间存在混合结构,例如碳纳米芽——纳米管被半球网格或更大的“布基球”包裹。
2.1 布基球
巴克明斯特富勒烯
巴克明斯特富勒烯是最小的包含五边形和六边形环的富勒烯分子,其中没有两个五边形共用一个边(这可能会破坏稳定,如戊搭烯)。就自然发生而言,它也是最常见的,因为它经常在煤烟中发现。
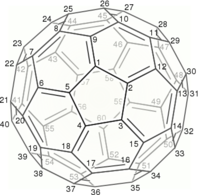
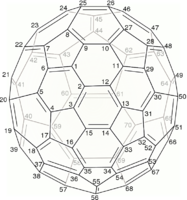
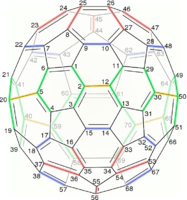
C60 的结构是一个截短的二十面体,类似于一个由20个六边形和12个五边形组成的英式足球,每个多边形的顶点都有一个碳原子,每个多边形的边上都有一个键。
一个 C60 分子的范德瓦尔斯直径约为1.1纳米。[16] C60 分子核到核的直径约为0.71 nm。
C60 分子有两个键长。6:6环键(在两个六边形之间)可以被认为是“双键”,比6:5键(在六边形和五边形之间)短。其平均键长度为1.4埃。
其他布基球
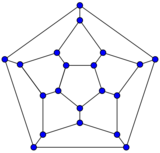
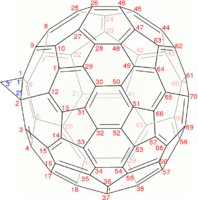
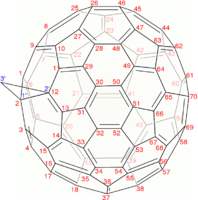
另一种相当常见的富勒烯是 C70,[17] 但是通常获得具有72、76、84甚至高达100个碳原子的富勒烯。
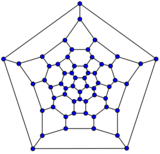
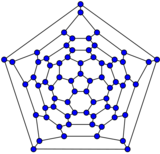
最小的富勒烯是十二面体 C20。没有22个顶点的富勒烯。[18] C2n 富勒烯的数量随着增长而增长,当 n = 12, 13, 14……时,数量大致与n9成比例 (OEIS中的数列A007894)。例如,有1812种不同构的富勒烯 C60。请注意,只有一种形式的 C60,即巴克明斯特富勒烯别名为截断二十面体,没有一对相邻的五边形(最小的这种富勒烯)。为了进一步说明这种生长,有214,127,713种同分异构的富勒烯 C200,其中15,655,672个没有相邻的五边形。许多富勒烯异构体的优化结构在网上公布和列出。[19]
异富勒烯在笼状或管状结构中具有取代碳的杂原子。它们是在1993年被发现的[20] ,极大地扩展了富勒烯类化合物的总量。值得注意的例子包括硼、氮(氮杂富勒烯)、氧和磷衍生物。
弗吉尼亚理工大学的研究人员发现了三甲氧磷碳纳米材料,并独家授权给露娜Luna公司。这类新型分子包含80个碳原子(C80)形成包围三个金属原子和一个氮原子的络合物的球体。这些富勒烯包裹金属,将它们归入金属富勒烯的子集。三甲氧苄星有潜力用于诊断(作为安全的成像剂)、治疗[21] 和有机太阳能电池。[22]
2.2 碳纳米管
碳纳米管是圆柱形富勒烯。这些碳管通常只有几纳米宽,但长度可以从不到一微米到几毫米不等。它们通常有封闭端,但也可以是开放端。也有在关闭之前管子直径减小的情况。它们独特的分子结构导致了非同寻常的宏观性质,包括高抗拉强度、高导电性、高延展性、高导热性和相对的化学惰性(因为它是圆柱形的和“平面的”——也就是说,它没有容易被置换的“暴露”原子)。伦斯勒理工学院的研究人员于2007年开发了纸电池,这是碳纳米管的一个拟议用途。[23] 空间技术领域的另一具有高度可行性的研究用途是生产空间升降机所需的高强度碳电缆。
3 衍生物编辑
4 异富勒烯和非碳富勒烯编辑
C60 发现后,许多富勒烯被合成(或通过分子模拟方法进行理论研究),富勒烯中的部分或所有碳原子被其他元素取代。特别是无机纳米管,已经引起了很多关注。
4.1 硅
硅布基球是围绕金属离子制造的。
4.2 硼
2007年预测和描述了一种使用硼原子而不是普通碳的布基球。 B80 结构,每个原子形成5或6个键,预计比 C60 布基球更稳定。[29] 研究者给出的一个原因是 B80 实际上更像是由巴克敏斯特·富勒推广的最初的测地线圆顶结构,它使用三角形而不是六边形。然而,这项工作受到了量子化学家的许多批评[30][31] ,因为可以得出结论,预测的Ih 对称结构在振动上是不稳定的,因此产生了自发的对称破缺,产生了一个罕见的、具有Th 对称性(排球的对称性)的褶皱笼。[30] 这个分子中六元环的数量是20,五元环的数量是12。在每个六元环的中心有一个附加的原子,与周围的每个原子成键。通过采用系统的全局搜索算法,后来发现先前提出的B80 富勒烯不是80原子硼簇的全局最小值,因此在自然界中找不到。[32] 桑迪普·德(Sandip De)等人在同一篇论文中得出结论,硼的能量图景与自然界中已经发现的其他富勒烯显著不同,因此纯硼富勒烯在自然界中不太可能存在。
4.3 其他元素
无机(无碳)富勒烯型结构已经用钼的二硫化物 (MoS)2合成,长期用作类似石墨的润滑剂,如钨(WS2),钛(TiS2)和铌(NbS2)。这些材料被发现在至少350t/cm2的范围内是稳定的 (34.3 GPa)。[33]
5 主要的富勒烯编辑
下表列出了迄今为止合成和表征的主要封闭碳富勒烯,以及已知的它们的CAS编号。[34] 碳原子含量少于60个的富勒烯被称为“低级富勒烯”,碳原子含量多于70个的富勒烯被称为“高级富勒烯”。
| 化学式 | 异构体数 | 分子对称性 | 晶体对称性 | 空间群 | No | 皮尔逊符号 | 晶胞参数 a (nm) | 晶胞参数 b (nm) | 晶胞参数 c (nm) | β° | Z | 密度 ρ (g/cm3) |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| C20 | 1 | Ih | ||||||||||
| C60 | 1 | Ih | ||||||||||
| C70 | 1 | D5h | ||||||||||
| C72 | 1 | D6h | ||||||||||
| C74 | 1 | D3h | ||||||||||
| C76 | 2 | D2* | Monoclinic | P21 | 4 | mP2 | 1.102 | 1.108 | 1.768 | 108.10 | 2 | 1.48 |
| Cubic | Fm3m | 225 | cF4 | 1.5475 | 1.5475 | 1.5475 | 90 | 4 | 1.64 | |||
| C78 | 5 | D2v | ||||||||||
| C80 | 7 | |||||||||||
| C82 | 9 | C2, C2v, C3v | Monoclinic | P21 | 4 | mP2 | 1.141 | 1.1355 | 1.8355 | 108.07 | 2 | |
| C84 | 24 | D2*, D2d | Cubic | Fm3m | 1.5817[35] | 1.5817 | 1.5817 | 90 | ||||
| C86 | 19 | |||||||||||
| C88 | 35 | |||||||||||
| C90 | 46 | |||||||||||
| C3996 |
在表中,“异构体数量”是“孤立五边形规则”中可能的异构体数量,该规则规定富勒烯中的两个五边形不应共享边。[36] “分子对称性”是分子的对称性,[37][38],而“晶体对称性”是其固态的晶型框架,两者都是针对实验中最丰富的形式指定的。星号 * 用多个手性形式标记对称性。
当 C76 或者 C82 晶体是从甲苯溶液中生长出来的时候,它们具有单斜对称性。晶体结构包含填充在富勒烯球体之间的甲苯分子。然而, C76 溶剂蒸发将其转换为面心立方形式。[39] 单斜相和面心立方结构相都以更好表征的 C60 和 C70富勒烯而闻名。
6 性能编辑
6.1 拓扑学
施莱格尔图常被用来阐明闭壳富勒烯的三维结构,因为2D投影往往并不理想。
用数学术语来说,具有简单球形平均表面(可定向,属零)的闭壳富勒烯的组合拓扑(即碳原子和它们之间的键,忽略它们的位置和距离)可以表示为凸多面体;更准确地说,它的一维骨架由顶点和边组成。施莱格尔图是骨架通过多面体的一个面外的点投影到多面体的一个面上;以便所有其他顶点都投影到该面内。
- 部分富勒烯的施莱格尔图
C20
C26(十二面体)
C60(截角二十面体)
C70
封闭富勒烯的施莱格尔图是三正则平面图(或“立方体”视图,意味着所有顶点都有3个自由度)。
具有球形壳的封闭富勒烯必须具有至少一些五边形或七边形的环。 更准确地说,如果所有的面都有5或6条边,那么它可以从欧拉多面体公式得到: V−E+F=2(其中 V, E, F 是顶点、边和面的数量), V 必须是偶数,并且必须恰好有12个五边形和V/2-10个六边形。如果富勒烯具有七元环,则存在类似的限制。[40]
开放的富勒烯,像碳纳米管和石墨烯,可以完全由六边形环组成。理论上,末端连接形成闭合环状片的长纳米管也可以完全由六边形组成。
6.2 成键
因为每个碳原子只连接三个相邻的碳原子,而不是通常的四个,所以通常将这些键描述为单共价键和双共价键的混合物。
6.3 包裹
即所谓的内嵌富勒烯,是指在笼状原子中含有离子或小分子。
6.4 研究
21世纪初,富勒烯的化学和物理性质一直是研究和开发领域的热门话题。 《大众科学》讨论富勒烯(石墨烯)在装甲中的可能用途。[41]
在纳米技术领域,耐热性和超导性是一些更深入研究的性质。
有许多计算已经使用应用于富勒烯的从头算量子方法完成。通过密度泛函理论和密度泛函理论方法可以获得红外、拉曼和紫外光谱。这种计算的结果可以与实验结果进行比较。
富勒烯是许多有机反应中不寻常的反应物,例如1993年发现的宾格尔反应。
6.5 芳香性
研究人员已经能够通过在其表面附着活性基团来增加富勒烯的反应性。巴克明斯特富勒烯不表现出“超芳族性”:也就是说,六边形环中的电子不会在整个分子上离域。
球形富勒烯 n 碳原子有 n π键电子,可以自由离域。这些应该试图使整个分子离域。这种排列的量子力学应该只像一个原子的众所周知的量子力学结构的一个壳,具有稳定的填充壳 n = 2、8、18、32、50、72、98、128等,即完全平方数的两倍;但是这个系列不包括n = 60的情况。球面芳香性的2(N + 1)2 规则(N 为整数)是休克尔规则的三维模拟。10+阳离子将满足这一规则,并且应该是芳香的。使用量子化学模型证明了这一点,该模型表明阳离子中存在强反磁性球体电流。[42]
因此, C60 在水中倾向于再吸收两个电子变为一个阴离子。下面描述的 nC60 的形成原因可能是 C60 试图形成一个松散的金属键。
7 反应编辑
7.1 聚合
在高压和高温下,布基球会塌陷形成各种一维、二维或三维碳框架。使用原子转移自由基加成聚合(ATRAP)路线形成单链聚合物[43]。
“超硬富勒烯”是一个常被用来描述富勒烯的高压高温(HPHT)加工产生的材料的新术语。这种处理将富勒烯转化为纳米晶形式的金刚石,据报道,这种金刚石具有显著的机械性能。[44]
7.2 化学
富勒烯是稳定的,但不是完全不活泼的。sp2杂化碳原子轨道在平面石墨中能量最低,必须弯曲形成闭合的球体或管,从而产生角应变。富勒烯的特征反应是在6,6-双键上的亲电加成,这通过改变sp2-杂化碳原子轨道为sp3杂化碳原子轨道来降低角应变。杂化轨道的变化导致键角从sp2中的约120°减小达到约sp3中轨道109.5°轨道。当成为闭合球体或管时,键角的减小使得键弯曲更小,因此分子变得更稳定。
其他原子可以被捕获在富勒烯中,形成被称为内嵌富勒烯的包合物。一个不寻常的例子是卵形富勒烯Tb3N@C84违反了孤立的五角大楼规则。[45] 最近,通过分析保存下来的稀有气体,发现了在二叠纪植物群末端发生流星撞击的证据。[46] 总部设在金属富勒烯的rhonditic钢铁公司开始生产巴克球,这是巴克球最早的商业可行用途之一。
7.3 溶解度
富勒烯可溶于许多有机溶剂,如甲苯、氯苯和1,2,3-三氯丙烷。溶解度通常相当低,比如C60 在二硫化碳中的溶解度为8 g/L。尽管如此,富勒烯是唯一已知的能在室温下溶解在普通溶剂中的碳同素异形体。 [47][48][49][50][51] 最好的溶剂是1-氯萘,它能溶解51g/L的C60 。
纯巴克明斯特富勒烯溶液呈深紫色。的解决方案 C70 是红棕色的。更高的富勒烯 C76 到 C84 有多种颜色。
毫米大小的晶体 C60 和 C70纯的和溶剂化的都可以从苯溶液中生长。C60 从低于30℃的苯溶液中结晶(当溶解度最大时),得到三斜固体溶剂化物 C60·4C6H6。在30℃以上可以获得无溶剂化物的fcc C60。[52][53]
7.4 量子力学
1999年,维也纳大学的研究人员证明了波粒二象性适用于富勒烯等分子。[54]
7.5 超导性
富勒烯通常是电绝缘体,但是当用碱金属结晶时,生成的化合物可以是导电的,甚至是超导的。[55]
7.6 手性分子
一些富勒烯(例如 C76, C78, C80,和 C84)本质上是手性的,因为它们是D2-对称,并已成功分辨。目前正在进行研究工作,主要是为它们的对映异构体开发特定的传感器。
7.7 稳定性
有两种理论被提出来用于描述富勒烯的分子机理。旧的“自下而上”理论认为它们是一个原子接一个原子构建的。另一种“自上而下”的方法声称富勒烯是在更大的结构分解成其组成部分时形成的。[56]
2013年,研究人员发现由较大结构形成的不对称富勒烯会沉淀成稳定的富勒烯。合成的物质是一种特殊的金属富勒烯,由84个碳原子和两个附加碳原子以及笼内的两个钇原子组成。这个过程的产物大约100微克。[56]
然而,研究人员发现基于不对称分子理论可以坍缩形成几乎所有已知的富勒烯和金属富勒烯。一些分子键断裂引起的微小扰动使笼子变得高度对称和稳定。这一观点支持了富勒烯可以在适当的分子键被切断时由石墨烯形成的理论。[56][57]
8 系统命名编辑
根据IUPAC,要命名富勒烯,必须引用组成富勒烯的环的成员原子的数量、其在舍恩菲利斯记法中的对称点群以及原子的总数。例如,巴克明斯特富勒烯C60 被系统地命名为(C60-Ih)[5,6]富勒烯。点群的名称应该保留在所述富勒烯的任何衍生物中,即使该衍生物失去了对称性。
为了指示取代或附着元素的位置,富勒烯原子通常以螺旋路径编号,通常从 其中一个有环的主轴上起始。如果富勒烯的结构不允许这种编号,则选择另一个起始原子来确保实现螺旋路径序列。
下面是C70的情况,它是(C70-D5h(6))[5,6]富勒烯以IUPAC标注规则命名的案例。对称性 D5h(6) 意味着这是异构体 C5 轴穿过由六边形包围的五边形而不是五边形包围的五边形。[58]
(C60-Ih)[5,6]fullerene 图中数字为碳原子编号
(C70-D5h(6))[5,6]fullerene 图中数字为碳原子编号
(C70-D5h(6))[5,6]fullerene 图中用颜色区分不同的非共价键,数字为碳原子编号
3'H-Cyclopropa[1,2](C70-D5h(6))[5,6]fullerene.
3'H-Cyclopropa[2,12](C70-D5h(6))[5,6]fullerene.
C71-PCBM, [1,2]-isomer.其IUPAC命名则为:methyl 4-(3’-phenyl-3’H-cyclopropa[1,2](C70-D5h(6))[5,6]fullerene-3’-yl)butyrate.
按照国际自然保护联盟的命名法, 富勒烯的完全饱和类似物被称为富勒烷。如果网格中有其他元素替代一个或多个碳,则该化合物被命名为异质富勒烯。如果双键被亚甲基桥取代 –CH
2–,得到的结构是同富勒烯。 如果一个原子被完全删除并且缺少氢原子饱和的化合价,它就是norfullerene。当键被移除时(σ和π),化合物变成赛科富勒烯;如果一些新化学键以非常规顺序加入,那就是环富勒烯。[58]
9 制作编辑
10 应用程序编辑
富勒烯已广泛用于多种生物医学应用,包括高性能磁共振造影剂的设计、X射线成像造影剂、光动力疗法以及药物和基因递送,综述如下。
10.1 医学研究
2003年4月,富勒烯被研究用于潜在的医学用途:将特异性抗生素结合到结构上,以靶向结合耐药细菌,甚至靶向结合某些癌细胞,如黑色素瘤。2005年10月号的Chemistry & Biology 中有一篇文章描述了富勒烯作为光活化抗菌剂的用途。[61]
10.2 肿瘤研究
虽然过去的癌症研究主要涉及放射疗法,不过光动力疗法同样很重要,因为肿瘤细胞治疗的突破将为不同病情的患者提供更多选择。最近在癌症研究中使用HeLa细胞的实验包括开发新的光敏剂,其被癌细胞吸收的能力增加,但仍会引发细胞死亡。同样重要的是,新的光敏剂要求不能在体内停留很长时间,以防止不必要的细胞损伤。[62]
富勒烯可以被HeLa细胞吸收。 C60 衍生物可以通过使用L-苯丙氨酸、叶酸和L-精氨酸等官能团传递到细胞中。[63]
富勒烯的官能化旨在增加癌细胞对分子的溶解性。由于癌细胞中转运蛋白的上调,癌细胞能够以更高的速度吸收这些分子,在这种情况下,氨基酸转运蛋白将引入富勒烯的L-精氨酸和L-苯丙氨酸官能团。[64]
一旦被细胞吸收, C60 衍生物通过将分子氧转化为活性氧来实现光辐射反应,从而触发HeLa细胞和其他能够吸收富勒烯分子的癌细胞凋亡。这项研究表明,一种反应性物质可以靶向癌细胞,然后被光辐射触发,在接受治疗的同时将对周围组织的损伤降至最低。[65]
当被癌细胞吸收并暴露在光辐射下时,产生活性氧的反应会破坏构成癌细胞的脱氧核糖核酸、蛋白质和脂质。这种细胞损伤迫使癌细胞发生凋亡,从而导致肿瘤体积缩小。一旦光辐射处理完成,富勒烯将重新吸收自由基,以防止对其他组织的损伤。[66] 由于这种治疗侧重于癌细胞,对于癌细胞在光照射范围内的患者来说,这是一个很好的选择。随着这项研究的继续,这种疗法可能会更深入身体,更有效地被癌细胞吸收。[62]
参考文献
- [1]
^Belkin, A.; et., al. (2015). "Self-Assembled Wiggling Nano-Structures and the Principle of Maximum Entropy Production". Sci. Rep. 5: 8323. Bibcode:2015NatSR...5E8323B. doi:10.1038/srep08323. PMC 4321171. PMID 25662746..
- [2]
^Schultz, H.P. (1965). "Topological Organic Chemistry. Polyhedranes and Prismanes". Journal of Organic Chemistry. 30 (5): 1361–1364. doi:10.1021/jo01016a005..
- [3]
^Osawa, E. (1970). "Superaromaticity". Kagaku. 25: 854–863..
- [4]
^Halford, B. (9 October 2006). "The World According to Rick". Chemical & Engineering News. 84 (41): 13–19. doi:10.1021/cen-v084n041.p013..
- [5]
^Thrower, P.A. (1999). "Editorial". Carbon. 37 (11): 1677–1678. doi:10.1016/S0008-6223(99)00191-8..
- [6]
^Henson, R.W. "The History of Carbon 60 or Buckminsterfullerene". Archived from the original on 15 June 2013..
- [7]
^Bochvar, D.A.; Galpern, E.G. (1973). "О гипотетических системах: карбододекаэдре, s-икосаэдре и карбо-s-икосаэдре" [On hypothetical systems: carbon dodecahedron, S-icosahedron and carbon-S-icosahedron]. Dokl. Akad. Nauk SSSR. 209: 610..
- [8]
^Iijima, S (1980). "Direct observation of the tetrahedral bonding in graphitized carbon black by high resolution electron microscopy". Journal of Crystal Growth. 50 (3): 675–683. Bibcode:1980JCrGr..50..675I. doi:10.1016/0022-0248(80)90013-5..
- [9]
^Buckminsterfullerene, C60. Sussex Fullerene Group. chm.bris.ac.uk.
- [10]
^"The Nobel Prize in Chemistry 1996". Retrieved 7 February 2014..
- [11]
^Mraz, S.J. (14 April 2005). "A new buckyball bounces into town". Machine Design. Archived from the original on 13 October 2008..
- [12]
^Iijima, Sumio (1991), "Helical microtubules of graphitic carbon", Nature, 354 (6348): 56–58, Bibcode:1991Natur.354...56I, doi:10.1038/354056a0.
- [13]
^Buseck, P.R.; Tsipursky, S.J.; Hettich, R. (1992). "Fullerenes from the Geological Environment". Science. 257 (5067): 215–7. Bibcode:1992Sci...257..215B. doi:10.1126/science.257.5067.215. PMID 17794751..
- [14]
^Starr, Michelle (29 April 2019). "The Hubble Space Telescope Has Just Found Solid Evidence of Interstellar Buckyballs". ScienceAlert.com. Retrieved 29 April 2019..
- [15]
^Cordiner, M.A.; et al. (22 April 2019). "Confirming Interstellar C60 + Using the Hubble Space Telescope". The Astrophysical Journal Letters. 875 (2). Retrieved 29 April 2019..
- [16]
^Qiao, Rui; Roberts, Aaron P.; Mount, Andrew S.; Klaine, Stephen J.; Ke, Pu Chun (2007). "Translocation of C60 and Its Derivatives Across a Lipid Bilayer". Nano Letters. 7 (3): 614–9. Bibcode:2007NanoL...7..614Q. CiteSeerX 10.1.1.725.7141. doi:10.1021/nl062515f. PMID 17316055..
- [17]
^Locke, W. (13 October 1996). "Buckminsterfullerene: Molecule of the Month". Imperial College. Retrieved 4 July 2010..
- [18]
^Meija, Juris (2006). "Goldberg Variations Challenge" (PDF). Analytical and Bioanalytical Chemistry. 385 (1): 6–7. doi:10.1007/s00216-006-0358-9. PMID 16598460..
- [19]
^Fowler, P. W. and Manolopoulos, D. E. Cn Fullerenes. nanotube.msu.edu.
- [20]
^Harris, D.J. "Discovery of Nitroballs: Research in Fullerene Chemistry" http://www.usc.edu/CSSF/History/1993/CatWin_S05.html.
- [21]
^Charles Gause. "Fullerene Nanomedicines for Medical and Healthcare Applications"..
- [22]
^"Luna Inc. Organic Photovoltaic Technology". 2014. Archived from the original on 28 March 2014..
- [23]
^Pushparaj, V.L.; Shaijumon, Manikoth M.; Kumar, A.; Murugesan, S.; Ci, L.; Vajtai, R.; Linhardt, R. J.; Nalamasu, O.; Ajayan, P. M. (2007). "Flexible energy storage devices based on nanocomposite paper". Proceedings of the National Academy of Sciences. 104 (34): 13574–7. Bibcode:2007PNAS..10413574P. doi:10.1073/pnas.0706508104. PMC 1959422. PMID 17699622..
- [24]
^Miessler, G.L.; Tarr, D.A. (2004). Inorganic Chemistry (3rd ed.). Pearson Education. ISBN 978-0-13-120198-9..
- [25]
^Sano, N.; Wang, H.; Chhowalla, M.; Alexandrou, I.; Amaratunga, G. A. J. (2001). "Synthesis of carbon 'onions' in water". Nature. 414 (6863): 506–7. Bibcode:2001Natur.414..506S. doi:10.1038/35107141. PMID 11734841..
- [26]
^Mitchel, D.R.; Brown, R. Malcolm Jr. (2001). "The Synthesis of Megatubes: New Dimensions in Carbon Materials". Inorganic Chemistry. 40 (12): 2751–5. doi:10.1021/ic000551q. PMID 11375691..
- [27]
^Shvartsburg, A.A.; Hudgins, R. R.; Gutierrez, Rafael; Jungnickel, Gerd; Frauenheim, Thomas; Jackson, Koblar A.; Jarrold, Martin F. (1999). "Ball-and-Chain Dimers from a Hot Fullerene Plasma" (PDF). Journal of Physical Chemistry A. 103 (27): 5275–5284. Bibcode:1999JPCA..103.5275S. doi:10.1021/jp9906379..
- [28]
^Li, Y.; Huang, Y.; Du, Shixuan; Liu, Ruozhuang (2001). "Structures and stabilities of C60-rings". Chemical Physics Letters. 335 (5–6): 524–532. Bibcode:2001CPL...335..524L. doi:10.1016/S0009-2614(01)00064-1..
- [29]
^Gonzalez Szwacki, N.; Sadrzadeh, A.; Yakobson, B. (2007). "B80 Fullerene: An Ab Initio Prediction of Geometry, Stability, and Electronic Structure". Physical Review Letters. 98 (16): 166804. Bibcode:2007PhRvL..98p6804G. doi:10.1103/PhysRevLett.98.166804. PMID 17501448..
- [30]
^Gopakumar, G.; Nguyen, M.T.; Ceulemans, A. (2008). "The boron buckyball has an unexpected Th symmetry". Chemical Physics Letters. 450 (4–6): 175–177. arXiv:0708.2331. Bibcode:2008CPL...450..175G. doi:10.1016/j.cplett.2007.11.030..
- [31]
^Prasad, D.; Jemmis, E. (2008). "Stuffing Improves the Stability of Fullerenelike Boron Clusters". Physical Review Letters. 100 (16): 165504. Bibcode:2008PhRvL.100p5504P. doi:10.1103/PhysRevLett.100.165504. PMID 18518216..
- [32]
^De, S.; Willand, A.; Amsler, M.; Pochet, P.; Genovese, L.; Goedecker, S. (2011). "Energy Landscape of Fullerene Materials: A Comparison of Boron to Boron Nitride and Carbon". Physical Review Letters. 106 (22): 225502. arXiv:1012.3076. Bibcode:2011PhRvL.106v5502D. doi:10.1103/PhysRevLett.106.225502. PMID 21702613..
- [33]
^Genuth, Iddo; Yaffe, Tomer (February 15, 2006). "Protecting the soldiers of tomorrow". IsraCast..
- [34]
^W. L. F. Armarego; Christina Li Lin Chai (11 May 2009). Purification of laboratory chemicals. Butterworth-Heinemann. pp. 214–. ISBN 978-1-85617-567-8. Retrieved 26 December 2011..
- [35]
^Margadonna, Serena; Brown, Craig M.; Dennis, T. John S.; Lappas, Alexandros; Pattison, Philip; Prassides, Kosmas; Shinohara, Hisanori (July 1998). "Crystal Structure of the Higher Fullerene C". Chemistry of Materials. 10 (7): 1742–1744. doi:10.1021/cm980183c..
- [36]
^Manolopoulos, David E.; Fowler, Patrick W. (1991). "Structural proposals for endohedral metal-fullerene complexes". Chemical Physics Letters. 187: 1. doi:10.1016/0009-2614(91)90475-O..
- [37]
^Diederich, Francois; Whetten, Robert L. (1992). "Beyond C60: The higher fullerenes". Accounts of Chemical Research. 25 (3): 119. doi:10.1021/ar00015a004..
- [38]
^K Veera Reddy (1 January 1998). Symmetry And Spectroscopy Of Molecules. New Age International. pp. 126–. ISBN 978-81-224-1142-3. Retrieved 26 December 2011..
- [39]
^Kawada, H.; Fujii, Y.; Nakao, H.; Murakami, Y.; Watanuki, T.; Suematsu, H.; Kikuchi, K.; Achiba, Y.; Ikemoto, I. (1995). "Structural aspects of C82 and C76 crystals studied by x-ray diffraction". Physical Review B. 51 (14): 8723. doi:10.1103/PhysRevB.51.8723..
- [40]
^"Fullerene", Encyclopædia Britannica on-line.
- [41]
^Erik Sofge (12 February 2014). "How Real Is 'RoboCop'?". Popular Science..
- [42]
^Johansson, M.P.; Jusélius, J.; Sundholm, D. (2005). "Sphere Currents of Buckminsterfullerene". Angewandte Chemie International Edition. 44 (12): 1843–6. doi:10.1002/anie.200462348. PMID 15706578..
- [43]
^Hiorns, R.C.; Cloutet, Eric; Ibarboure, Emmanuel; Khoukh, Abdel; Bejbouji, Habiba; Vignau, Laurence; Cramail, Henri (2010). "Synthesis of Donor-Acceptor Multiblock Copolymers Incorporating Fullerene Backbone Repeat Units". Macromolecules. 14. 43 (14): 6033–6044. Bibcode:2010MaMol..43.6033H. doi:10.1021/ma100694y..
- [44]
^Blank, V.; Popov, M.; Pivovarov, G.; Lvova, N.; Gogolinsky, K.; Reshetov, V. (1998). "Ultrahard and superhard phases of fullerite C60: Comparison with diamond on hardness and wear". Diamond and Related Materials. 7 (2–5): 427–431. Bibcode:1998DRM.....7..427B. CiteSeerX 10.1.1.520.7265. doi:10.1016/S0925-9635(97)00232-X..
- [45]
^Beavers, C.M.; Zuo, T. (2006). "Tb3N@C84: An improbable, egg-shaped endohedral fullerene that violates the isolated pentagon rule". Journal of the American Chemical Society. 128 (35): 11352–3. doi:10.1021/ja063636k. PMID 16939248..
- [46]
^Luann, B.; Poreda, Robert J.; Hunt, Andrew G.; Bunch, Theodore E.; Rampino, Michael (2007). "Impact Event at the Permian-Triassic Boundary: Evidence from Extraterrestrial Noble Gases in Fullerenes". Science. 291 (5508): 1530–3. Bibcode:2001Sci...291.1530B. doi:10.1126/science.1057243. PMID 11222855..
- [47]
^Beck, Mihály T.; Mándi, Géza (1997). "Solubility of C60". Fullerenes, Nanotubes and Carbon Nanostructures. 5 (2): 291–310. doi:10.1080/15363839708011993..
- [48]
^Bezmel'nitsyn, V.N.; Eletskii, A.V.; Okun', M.V. (1998). "Fullerenes in solutions". Physics-Uspekhi. 41 (11): 1091–1114. Bibcode:1998PhyU...41.1091B. doi:10.1070/PU1998v041n11ABEH000502..
- [49]
^Ruoff, R.S.; Tse, Doris S.; Malhotra, Ripudaman; Lorents, Donald C. (1993). "Solubility of fullerene (C60) in a variety of solvents" (PDF). Journal of Physical Chemistry. 97 (13): 3379–3383. doi:10.1021/j100115a049..
- [50]
^Sivaraman, N.; Dhamodaran, R.; Kaliappan, I.; Srinivasan, T. G.; Vasudeva Rao, P. R. P.; Mathews, C. K. C. (1994). "Solubility of C70 in Organic Solvents". Fullerene Science and Technology. 2 (3): 233–246. doi:10.1080/15363839408009549..
- [51]
^Semenov, K. N.; Charykov, N. A.; Keskinov, V. A.; Piartman, A. K.; Blokhin, A. A.; Kopyrin, A. A. (2010). "Solubility of Light Fullerenes in Organic Solvents". Journal of Chemical & Engineering Data. 55: 13–36. doi:10.1021/je900296s..
- [52]
^Talyzin, A.V. (1997). "Phase Transition C60−C60*4C6H6 in Liquid Benzene". Journal of Physical Chemistry B. 101 (47): 9679–9681. doi:10.1021/jp9720303..
- [53]
^Talyzin, A.V.; Engström, I. (1998). "C70 in Benzene, Hexane, and Toluene Solutions". Journal of Physical Chemistry B. 102 (34): 6477–6481. doi:10.1021/jp9815255..
- [54]
^Arndt, M.; Nairz, Olaf; Vos-Andreae, Julian; Keller, Claudia; Van Der Zouw, Gerbrand; Zeilinger, Anton (1999). "Wave-particle duality of C60" (PDF). Nature. 401 (6754): 680–2. Bibcode:1999Natur.401..680A. doi:10.1038/44348. PMID 18494170..
- [55]
^Katz, E. A. (2006). "Fullerene Thin Films as Photovoltaic Material". In Sōga, Tetsuo. Nanostructured materials for solar energy conversion. Elsevier. pp. 372, 381. ISBN 978-0-444-52844-5..
- [56]
^Support for top-down theory of how 'buckyballs’ form. kurzweilai.net. 24 September 2013.
- [57]
^Zhang, J.; Bowles, F. L.; Bearden, D. W.; Ray, W. K.; Fuhrer, T.; Ye, Y.; Dixon, C.; Harich, K.; Helm, R. F.; Olmstead, M. M.; Balch, A. L.; Dorn, H. C. (2013). "A missing link in the transformation from asymmetric to symmetric metallofullerene cages implies a top-down fullerene formation mechanism". Nature Chemistry. 5 (10): 880–885. Bibcode:2013NatCh...5..880Z. doi:10.1038/nchem.1748. PMID 24056346..
- [58]
^Kroto, H.W.; Heath, J. R.; Obrien, S. C.; Curl, R. F.; Smalley, R. E. (1985). "C60: Buckminsterfullerene". Nature. 318 (6042): 162–163. Bibcode:1985Natur.318..162K. doi:10.1038/318162a0..
- [59]
^Arikawa, Mineyuki (2006). "Fullerenes—an attractive nano carbon material and its production technology". Nanotechnology Perceptions. 2 (3): 121–128. ISSN 1660-6795..
- [60]
^Katz, E. A. (2006). "Fullerene Thin Films as Photovoltaic Material". In Sōga, Tetsuo. Nanostructured materials for solar energy conversion. Elsevier. pp. 361–443. doi:10.1016/B978-044452844-5/50014-7. ISBN 978-0-444-52844-5..
- [61]
^Tegos, G. P.; Demidova, T. N.; Arcila-Lopez, D.; Lee, H.; Wharton, T.; Gali, H.; Hamblin, M. R. (2005). "Cationic Fullerenes Are Effective and Selective Antimicrobial Photosensitizers". Chemistry & Biology. 12 (10): 1127–1135. doi:10.1016/j.chembiol.2005.08.014. PMC 3071678. PMID 16242655..
- [62]
^Brown, S.B.; Brown, E.A.; Walker, I. (2004). "The present and future role of photodynamic therapy in cancer treatment". Lancet Oncology. 5 (8): 497–508. doi:10.1016/S1470-2045(04)01529-3. PMID 15288239..
- [63]
^Mroz, Pawel; Pawlak, Anna; Satti, Minahil; Lee, Haeryeon; Wharton, Tim; Gali, Hariprasad; Sarna, Tadeusz; Hamblin, Michael R. (2007). "Functionalized fullerenes mediate photodynamic killing of cancer cells: type I versus typee II photochemical mechanism". Free Radical Biology & Medicine. 43 (5): 711–719. doi:10.1016/j.freeradbiomed.2007.05.005. PMC 1995806. PMID 17664135..
- [64]
^Ganapathy, Vadivel; Thanaraju, Muthusamy; Prasad, Puttur D. (2009). "Nutrient transporters in cancer: Relevance to Warburg hypothesis and beyond". Pharmacology & Therapeutics. 121 (1): 29–40. doi:10.1016/j.pharmthera.2008.09.005. PMID 18992769..
- [65]
^Hu, Zhen; Zhang, Chunhua; Huang, Yudong; Sun, Shaofan; Guan, Wenchao; Yao, Yuhuan (2012). "Photodynamic anticancer activities of water-soluble C60 derivatives and their biological consequences in a HeLa cell line". Chemico-Biological Interactions. 195 (1): 86–94. doi:10.1016/j.cbi.2011.11.003. PMID 22108244..
- [66]
^Markovic, Zoran; Trajkovic, Vladimir (2008). "Biomedical potential of the reactive oxygen species generation and quenching by fullerenes". Biomaterials. 29 (26): 3561–3573. doi:10.1016/j.biomaterials.2008.05.005. PMID 18534675..
- [67]
^G. Lalwani and B. Sitharaman, Multifunctional fullerene and metallofullerene based nanobiomaterials, NanoLIFE 08/2013; 3:1342003. DOI: 10.1142/S1793984413420038 Full Text PDF.
暂无