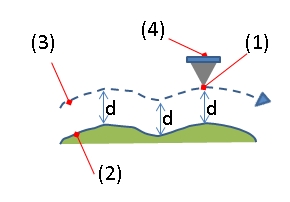
原子力显微镜
编辑原子力显微镜(AFM)或扫描力显微镜(SFM)是一种非常高分辨率类型的扫描探针显微镜(SPM),其显示的分辨率为纳米量级,比光学衍射极限高1000倍以上。
目录编辑
1 综述编辑
原子力显微镜(AFM)是一种扫描探针显微镜(SPM),其分辨率在纳米量级,比光学衍射极限高1000倍以上。信息是通过用机械探针“感觉”或“触摸”表面来收集的。压电元件有助于根据(电子)命令进行微小但精确的移动,从而实现精确扫描。
1.1 能力
原子力显微镜有三种主要能力:力测量、成像和操作。
在力测量中,原子力显微镜可以用来测量探针和样品之间的力,作为它们相互分离的函数。这可以应用于力谱分析,测量样品的机械特性,例如样品的杨氏模量硬度测量。
对于成像来说,探针对样品施加在其上的力的反应可以用于以高分辨率形成样品表面的三维形状(形貌)的图像。这是通过光栅扫描样品相对于尖端的位置并记录对应于恒定探针-样品相互作用的探针高度来实现的(详见原子力显微镜中的地形成像部分)。表面形貌通常显示为伪彩色图。
在操作中,尖端和样品之间的力也可以通过可控的方式来改变样品的性质。这方面的例子包括原子操作、扫描探针光刻和细胞的局部刺激。
在采集形貌图像的同时,可以局部测量样品的其他特性,并显示为图像,通常具有类似的高分辨率。这种性质的例子是机械性质,如硬度或粘合强度,以及电性质,如导电性或表面电势。事实上,大多数SPM技术是使用这种模式的AFM的扩展。
1.2 其他显微镜技术
原子力显微镜与光学显微镜和电子显微镜等竞争技术的主要区别在于原子力显微镜不使用透镜或光束照射。 因此,它不会因衍射和像差而受到空间分辨率的限制,并且不需要准备用于引导光束(通过产生真空)和对样品染色的空间。
扫描显微镜有几种类型,包括扫描探针显微镜(包括AFM、扫描隧道显微镜(STM)和近场扫描光学显微镜(SNOM/NSOM)、STED显微镜(STED),以及扫描电子显微镜和电化学原子力显微镜EC-AFM)。尽管SNOM和STED使用可见光、红外线甚至太赫兹光照射样品,但它们的分辨率不受衍射极限的限制。
1.3 配置
图3显示了一台原子力显微镜,它通常由以下特征组成。[1] 括号中的数字对应于图3中的编号特征。坐标方向由坐标系(0)定义。
小弹簧状悬臂(1)由支架(2)承载。可选地,压电元件(通常由陶瓷材料制成)(3)振荡悬臂(1)。尖端(4)固定在悬臂(1)的自由端。检测器(5)记录悬臂(1)的偏转和运动。样品(6)安装在样品台(8)上。 xyz驱动器(7)允许在x、y和z方向上慎重地移动样品(6)和样品台(8)至尖端(4)。虽然图3显示了连接到样品的驱动器,但是驱动器也可以连接到尖端,或者独立的驱动器可以连接到两者,因为需要控制样品和尖端的相对位移。控制器和绘图仪未在图3中示出。
根据上述配置,尖端和样品之间原子尺度现象的相互作用被转换成了宏观尺度现象的悬臂运动变化。悬臂运动的几个不同方面可用于量化尖端和样品之间的相互作用,最常见的是偏转值、悬臂施加的振动幅度或悬臂共振频率的偏移(参见成像模式部分)。
检测器
原子力显微镜的检测器(5)测量悬臂的偏转(相对于平衡位置的位移),并将其转换成电信号。这个信号的强度将与悬臂的位移成正比。
可以使用各种检测方法,例如干涉测量法、光学杠杆法、压阻法、压电法和基于扫描隧道显微镜的检测器(参见“原子力显微镜悬臂挠度测量”部分)。
图像形成
注意:以下段落假设使用“接触模式”(参见成像模式一节)。对于其他成像模式,这个过程是相似的,除了“偏转”应该被适当的反馈变量代替。
当使用原子力显微镜对样品成像时,尖端与样品接触,样品沿x-y网格进行光栅扫描(图4)。最常见的是,在扫描过程中使用电子反馈回路来保持探针样品力常数。该反馈回路以悬臂偏转为输入,其输出控制探针支架(图3中的2)和样品支架(图3中的8)之间沿z轴的距离。只要尖端与样品保持接触,并且样品在x-y平面上扫描,样品的高度变化将改变悬臂的偏转。然后,反馈调节探头支架的高度,使偏转恢复到用户定义的值(设定点)。适当调整的反馈回路在扫描运动期间连续调整支架-样品分离,使得偏转保持近似恒定。在这种情况下,反馈输出等于样品表面形貌,误差很小。
历史上,使用了一种不同的操作方法,样品探针支撑距离保持恒定,不受反馈(伺服机构)控制。在这种通常称为“恒定高度模式”的模式下,悬臂的偏转被记录为样品x-y位置的函数。只要尖端与样品接触,偏转就对应于表面形貌。这种方法不再受欢迎的主要原因是针尖和样品之间的力没有得到控制,这可能导致力高到足以损坏针尖或样品。然而,即使在“恒力模式”下扫描,也有反馈记录偏转的常见做法。这揭示了反馈的小跟踪误差,有时还揭示了反馈无法调整的特征。
在x-y扫描期间,原子力显微镜信号,如样品高度或悬臂偏转,被记录在计算机上。它们被绘制成伪彩色图像,其中每个像素代表样本上的x-y位置,颜色代表记录的信号。
1.4 历史
原子力显微镜是由IBM科学家在1982年发明的。[2] 原子力显微镜的前身,扫描隧道显微镜 (STM),是由Gerd Binnig和Heinrich Rohrer于20世纪80年代初在IBM研究院-苏黎士开发的,这一发展为他们赢得了1986年诺贝尔物理学奖。Binnig发明了原子力显微镜,[1] 1986年,Binnig、Quate和Gerber完成了原子力显微镜的第一次实验。[3]
第一台商用原子力显微镜于1989年推出。原子力显微镜是纳米尺度上成像、测量和操纵物质的最重要工具之一。
1.5 应用程序
原子力显微镜已经应用于自然科学的许多学科中的问题,包括固体物理、半导体科学和技术、分子工程、聚合物化学和物理、表面化学、分子生物学、细胞生物学和医学。
固态物理领域的应用包括(a)表面原子的识别,(b)特定原子与其相邻原子之间相互作用的评估,以及(c)通过原子操作对原子排列变化引起的物理性质变化的研究。
在分子生物学中,原子力显微镜可以用来研究蛋白质复合物和组件的结构和机械性能。例如,原子力显微镜已经用于微管成像和测量它们的硬度。
在细胞生物学中,原子力显微镜可用于根据细胞硬度来区分癌细胞和正常细胞,并在竞争性培养系统中评估特定细胞与其相邻细胞之间的相互作用。原子力显微镜也可以用来缩进细胞,研究它们如何调节细胞膜或细胞壁的硬度或形状。
在一些变体中,电势也可以使用导电悬臂来扫描。在更高级的版本中,电流可以通过尖端来探测导电性或下表面的迁移,但是这是一项具有挑战性的任务,很少有研究小组报告一致的数据(截至2004年)。[4]
2 原则编辑
原子力显微镜包括一个悬臂,其末端有一个尖锐的尖端(探针),用于扫描样品表面。悬臂通常是硅或氮化硅,其尖端曲率半径为纳米量级。当尖端靠近样品表面时,尖端和样品之间的力导致悬臂根据胡克定律偏转。[5] 根据这种情况,原子力显微镜测量的力包括机械接触力、范德华力、毛细管力、化学键、静电力、磁力(见磁力显微镜,MFM),卡西米尔力、溶解力等。除了力之外,还可以通过使用特殊类型的探针同时测量额外的量(参见扫描热显微镜、扫描焦耳膨胀显微镜、光热显微镜等)。
原子力显微镜可以在多种模式下工作,具体取决于应用。 通常,可能的成像模式分为静态(也称为接触)模式和悬臂以给定频率振动或振荡的各种动态(非接触或“敲击”)模式。
2.1 成像模式
根据尖端运动的性质,原子力显微镜的操作通常被描述为三种模式之一的接触模式,也称为静态模式(与称为动态模式的其他两种模式相反);敲击模式,也称为间歇接触、交流模式或振动模式,或在检测机制后调幅AFM;非接触模式,或者再次在检测机制之后,频率调制AFM。
应该注意的是,尽管有命名法,排斥接触在调幅原子力显微镜和调频原子力显微镜中都可以发生或避免,这取决于设置。
接触模式
在接触模式下,尖端被“拖动”穿过样品表面,表面轮廓或者直接使用悬臂的偏转来测量,或者更常见的是,使用将悬臂保持在恒定位置所需的反馈信号来测量。因为静态信号的测量容易产生噪声和漂移,所以使用低刚度悬臂(即具有低弹簧常数k的悬臂)来获得足够大的偏转信号,同时保持低相互作用力。靠近样品表面,吸引力可能相当强,导致尖端“卡入”表面。因此,接触模式原子力显微镜几乎总是在合力排斥的深度进行,即与固体表面牢固“接触”。
敲击模式
在环境条件下,大多数样品形成液体弯月层。因此,保持探针尖端足够靠近样品,以使短程力变得可检测,同时防止尖端粘附到表面,这对于环境条件下的接触模式来说是一个主要问题。动态接触模式(也称为间歇接触、交流模式或分接模式)被开发来绕过这个问题。[6] 如今,在环境条件或液体中操作时,分流模式是最常用的原子力显微镜模式。
在 敲击模式中,悬臂被驱动以在其共振频率或附近上下振荡。这种振荡通常通过悬臂支架中的小压电元件来实现,但是也有其他可能性,包括交流磁场(具有磁悬臂)、压电悬臂或用调制激光束周期性加热。这种振荡的振幅通常从几纳米到 200 nm。在敲击模式下,驱动信号的频率和振幅保持恒定,只要没有漂移或与表面的相互作用,就会导致悬臂振荡的恒定振幅。当探针靠近样品时,尖端靠近表面时悬臂上的作用力、范德华力、偶极-偶极相互作用、静电力等导致悬臂振动的幅度改变(通常减小)。该振幅用作进入电子伺服系统的参数,该伺服系统控制样品上方悬臂的高度。当悬臂在样品上扫描时,伺服机构调整高度以保持设定的悬臂振幅。敲击原子力显微镜 通过对尖端与样品表面间歇接触的力进行成像来产生图像。
尽管在振动的接触部分施加的峰值力可能比接触模式中通常使用的大得多,但是与接触模式中施加的力相比,敲击模式通常减少了对表面和尖端的损伤。这可以用施加力的持续时间短来解释,并且因为在敲击模式下尖端和样品之间的侧向力明显低于接触模式。敲击模式成像足够温和,甚至支持脂质双分子层或吸附的单个聚合物分子成像(例如,合成聚电解质的0.4 nm厚链)。通过适当的扫描参数,单个分子的构象可以保持数小时不变,[7] 甚至单分子马达也可以在移动时成像。
当在敲击模式下操作时,悬臂相对于驱动信号的振荡相位也可以被记录。该信号通道包含关于悬臂在每个振荡周期中消耗的能量信息。包含不同硬度或不同粘附特性区域的样品可以在该通道中产生在形貌图像中不可见的对比度。然而,从相位图像中以定量方式提取样品的材料特性通常是不可行的。
非接触模式
在非接触原子力显微镜模式下,悬臂的尖端不接触样品表面。相反,悬臂以其谐振频率(频率调制)或刚好高于谐振频率(幅度调制)振荡,其中振荡幅度通常为几纳米(< 10 nm),低至几皮米。[8] 范德华力在离表面从1 nm至10 nm时最强,或任何其他延伸到表面上的长程力,都会降低悬臂的共振频率。谐振频率的这种降低与反馈回路系统相结合,通过调整平均尖端到样品的距离来保持恒定的振荡幅度或频率。在每个(x,y)数据点对尖端到样品距离的测量,让扫描软件构建出样品表面的形貌图像。
非接触式原子力显微镜不会受到尖端或样品降解效应的影响,这种效应有时在用接触式原子力显微镜进行多次扫描后被观察到。这使得非接触式原子力显微镜比接触式原子力显微镜更适于测量软样品,例如生物样品和有机薄膜。在测量刚性样品时,接触和非接触图像可能看起来相同。然而,如果几个单层的吸附流体位于刚性样品的表面,图像可能看起来很不一样。在接触模式下操作的原子力显微镜将穿透液体层,只对下面的表面成像,而在非接触模式下,原子力显微镜将在吸附的流体层上方振荡,对液体和表面均能成像。
动态模式操作的方案包括频率调制和更常见的振幅调制,频率调制中使用锁相环跟踪悬臂的共振频率,振幅调制中使用伺服环路将悬臂激励保持在规定的振幅。 在频率调制中,振荡频率的变化提供了关于尖端-样品相互作用的信息。 频率可以以非常高的灵敏度测量,因此频率调制模式允许使用非常坚硬的悬臂。刚性悬臂提供非常接近表面的稳定性,因此,这种技术是第一种在超高真空条件下提供真正原子分辨率的原子力显微镜技术。[9]
在调幅中,振幅或相位的变化为成像提供反馈信号。 在调幅中,振荡相位的变化可以用来区分表面上不同类型的材料。调幅可以在非接触或间歇接触模式下操作。在动态接触模式下,悬臂被振荡,使得悬臂尖端和样品表面之间的分离距离被调节。
振幅调制也已经在非接触状态中使用,通过在超高真空环境中使用非常坚硬的悬臂和小振幅,以原子分辨率成像。
3 形貌图像编辑
图像形成是一种绘图方法,其通过改变尖端的x-y位置,同时扫描和记录测量变量,即控制信号的强度,来产生到每个x-y坐标的颜色映射。颜色映射显示对应于每个坐标的测量值。图像将值的强度表示为色调。通常,值的强度和色调之间的对应关系在图像的注释中显示为色标。
3.1 原子力显微镜的形貌图是什么?
从它是否使用z反馈回路(未示出)来保持尖端-样本距离以保持由检测器输出的信号强度的角度来看,原子力显微镜的成像操作模式通常分为两组。第一个(使用z反馈回路),被称为“恒定XX模式”(XX是由z反馈回路保持的东西)。
形貌图像形成模式基于上述“恒定XX模式”,Z反馈回路通过输出控制信号来控制探针和样品之间的相对距离,以保持频率、振动和相位中的恒定一个,该恒定通常对应于悬臂的运动,例如,电压被施加到Z压电元件,并且它将样品沿Z方向上下移动。
细节将在下一节中解释,特别是在原子力显微镜中的“恒定测向模式”(FM-AFM)作为实例。
3.2 FM-AFM的形貌图
当探针和样品之间的距离达到可以检测到原子力的范围时,悬臂在其固有本征频率(f0)被激发,悬臂的共振频率(f)会偏离其原始共振频率(固有本征频率)。换句话说,在可以检测到原子力的范围内,频移(df=f-f0)将被观察到。因此,当探针和样品之间的距离处于非接触区域时,随着探针和样品之间的距离变小,频移沿负方向增加。
当样品具有凹度和凸度时,顶端和样品之间的距离根据凹度和凸度而变化,同时沿着x-y方向扫描样品(z方向没有高度调节)。结果,频率偏移出现。通过沿样品表面x-y方向的光栅扫描获得的频率值相对于每个测量点的x-y坐标绘制的图像称为恒定高度图像。
另一方面,当沿着x-y方向对样本表面进行光栅扫描时,可以通过使用负反馈(通过使用z反馈回路)在z方向上下移动探针(参见图5的(3))来保持df恒定。负反馈量(探头在z方向上下移动的距离)相对于每个测量点的x-y坐标绘制的图像就是形貌图像。换句话说,形貌图是探头尖端的轨迹,探头尖端经过调节使得测向恒定,它也可以被认为是测向恒定高度表面的图。
因此,原子力显微镜的形貌图像本身不是精确的表面形貌,而是实际上受探针和样品之间键序影响的图像,然而,原子力显微镜的形貌图像被认为比扫描隧道显微镜的形貌图像更能反映表面的地理形状。
4 力谱编辑
原子力显微镜的另一个主要应用(除了成像)是力谱,它直接测量作为尖端和样品之间间隙函数的尖端-样品相互作用力(测量的结果称为力-距离曲线)。对于这种方法,当悬臂的偏转被监测为压电位移的函数时,原子力显微镜的尖端向表面伸出或从表面缩回。这些测量已被用于测量纳米接触、原子键合、范德华力和卡西米尔力、液体中的溶解力以及单分子拉伸和破裂力。[10] 此外,原子力显微镜被用于在水环境中测量由于聚合物吸附在基底上而产生的色散力。[11] 几皮牛顿量级的力现在可以常规测量,垂直距离分辨率优于0.1纳米。力谱可以用静态或动态模式进行。在动态模式下,除了静态偏转之外,还监控关于悬臂振动的信息。[12]
该技术的问题包括没有直接测量尖端-样品分离,以及通常需要低刚度悬臂,这些悬臂倾向于“卡”在表面上。这些问题并非不可克服。已经开发了一种直接测量针尖-样品分离的原子力显微镜。[13] 可以通过在液体中测量或使用更硬的悬臂来减少咬合,但在后一种情况下,需要更灵敏的偏转传感器。通过对尖端施加小扰动,也可以测量结合的刚度(力梯度)。[14]
4.1 生物应用和其他
力谱在生物物理学中用于测量生物材料(如组织或细胞)的机械特性[15][16][17] 或者使用刚度层析成像检测埋在大部分样品中的不同刚度的结构。[18] 另一个应用是从一只手测量粘附在悬臂顶端的材料与另一只手测量自由或被相同材料占据的颗粒表面之间的相互作用力。根据附着力分布曲线,推导出力的平均值。它能够绘制粒子表面的地图,无论是否被物质覆盖。[19]
5 单个表面原子的识别编辑
原子力显微镜可用于对各种表面上的原子和结构进行成像和摆布成像。 当顶端的原子与每一个原子形成初始化学键时,它“感知”下面表面的单个原子。 因为这些化学相互作用微妙地改变了尖端的振动频率,所以它们可以被探测到并绘制出来。通过将这些“原子指纹”与从大规模密度泛函理论(DFT)模拟中获得的值进行比较,该原理被用于区分合金表面上的硅、锡和铅原子。[20]
诀窍是首先精确测量样品中每种原子的作用力,然后与密度泛函理论模拟给出的作用力进行比较。该团队发现尖端与硅原子的相互作用最强,与锡和铅原子的相互作用分别弱24%和41%。 因此,当尖端在表面上移动时,可以在矩阵中识别每种不同类型的原子。
6 探针编辑
原子力显微镜探针在悬臂的自由摆动端有一个从支架伸出的尖锐的端头。[21] 悬臂的尺寸以微米为单位。尖端的半径通常在几纳米到几十纳米的范围内。(专用探针的末端半径要大得多,例如用于软材料压痕的探针。) 悬臂支架,也称为支架芯片——通常为1.6 ×3.4毫米大小,允许操作者用镊子夹住原子力显微镜悬臂/探针组件,并将其安装到原子力显微镜扫描头上相应的夹具中。
这种设备通常被称为“原子力显微镜探针”,但其他名称包括“原子力显微镜探针”和“悬臂”(使用单个部件的名称作为整个设备的名称)。原子力显微镜探针是一种特殊类型的扫描探针显微镜探针。
原子力显微镜探头采用微机电系统技术制造。大多数原子力显微镜探针由硅制成,但硼硅酸盐玻璃和氮化硅也在使用中。原子力显微镜探针被认为是消耗品,因为当尖端变钝或被污染或悬臂断裂时,它们经常被替换。 对于最专业的悬臂/探针组合,每个悬臂的成本从几十美元到数百美元不等。
仅仅是尖端非常靠近被研究物体的表面,悬臂由于尖端和表面之间的相互作用就产生偏转,这就是原子力显微镜设计测量的目的。通过测量2D表面上许多点的挠度,可以制作相互作用的空间图。
原子力显微镜可以检测到几种类型的交互。根据所研究的相互作用,原子力显微镜探针尖端的表面需要用涂层进行修饰。所用的涂层包括金——用于生物分子的共价结合以及检测它们与表面的相互作用,[22] 增加钻石的耐磨性[23] 和用于检测所研究表面磁性的磁性涂层。[24] 存在另一种实现高分辨率磁成像的解决方案:使探针配备微液体。原子力显微镜尖端采用硅微加工制造,微液体回路的精确定位通过电子束光刻完成。[25]
悬臂的表面也可以修改。这些涂层主要用于增加悬臂的反射率和改善偏转信号。
7 力与尖端几何形状编辑
尖端和样品之间的力很大程度上取决于尖端的几何形状。在过去的几年中,利用了各种研究来将力写成尖端参数的函数。
在尖端和样品之间的不同力中,水弯月面力在空气和液体环境中都非常有趣。其他力也必须要考虑,如库仑力、范德华力、双层相互作用、溶剂化力、水合力和疏水力。
7.1 水弯月面
空气中的水弯月面力对于原子力显微镜测量非常有趣。由于环境湿度,在空气测量过程中,针尖和样品之间会形成一薄层水。由此产生的毛细作用力会产生一个强大的吸引力,将尖端拉到表面上。事实上,在有限湿度的环境空气中测得的尖端和样品之间的粘附力通常由毛细管力决定。因此,很难将尖端从表面拉开。对于包含许多聚合物,特别是生物材料的软样品,在接触模式下成像时,强粘合毛细管力会导致样品降解和破坏。从历史上看,这些问题是发展空中动态成像(如“敲击模式”)的重要动力。在空气中进行敲击模式成像时,毛细管桥仍会形成。然而,对于合适的成像条件,毛细管桥在垂直于表面的悬臂的每个振荡周期中形成和断裂,这可以从悬臂振幅和相位对距离曲线的分析中推断出来。[26] 因此,破坏性剪切力大大降低,软样品可以进行研究。
为了量化平衡毛细管力,有必要从拉普拉斯压力方程开始:
其中γL 为表面能,r0 和r1 在图中有定义。
压力施加在
其中d、θ和h如图所示。
将两个表面拉在一起的力是
同样的公式也可以作为相对湿度的函数来计算。
高 [27] 推出不同尖端几何形状的计算公式。例如,圆锥形尖端相对于球形尖端的可能降低了20%。
当计算这些力时,必须区分干湿情况。
对于球形尖端,力为:
干湿两用
湿漉漉的
其中θ是干球的接触角,φ是浸没角,如图所示。
对于锥形尖端,公式为:
干湿两用
湿漉漉的
其中δ是半锥角,r0 和h是弯月面轮廓的参数。
8 原子力显微镜悬臂偏转测量编辑
8.1 光束偏转测量
悬臂挠度测量最常用的方法是梁挠度法。在这种方法中,来自固态二极管的激光从悬臂背面反射,并由位置敏感检测器(PSD)收集,该检测器由两个紧密间隔的光电二极管组成,其输出信号由差分放大器收集。悬臂的角位移导致一个光电二极管比另一个光电二极管收集更多的光,产生与悬臂偏转成正比的输出信号(光电二极管信号之间的差值通过它们的和归一化)。光束偏转法的灵敏度非常高,在设计良好的系统中,可以常规获得约为10 fm Hz−1⁄2 的噪声基底。虽然这种方法有时被称为“光学杠杆”方法,但如果光路变长,信号就不会被放大。更长的光路增加了光电二极管上反射光斑的运动,但由于衍射也使光斑变宽了相同的量,使得相同量的光功率从一个光电二极管移动到另一个光电二极管。“光学杠杆”(检测器的输出信号除以悬臂的偏转)与光束聚焦光学器件的数值孔径成反比,只要聚焦的激光光斑足够小以完全落在悬臂上。它也与悬臂的长度成反比。
梁偏转法的相对普及可以解释为它的高灵敏度和简单的操作,以及悬臂不需要电接触或其他特殊处理,因此可以相对便宜地用锋利的集成尖端制造。
8.2 其他挠度测量方法
还有许多其他测量光束偏转的方法。
- 压电检测 –由石英制成的悬臂[28] (例如qPlus结构)或其他压电材料可以直接检测偏转作为电信号。用这种方法检测到了10 pm以下的悬臂振动。
- 激光多普勒振动测量 –激光多普勒测振仪可用于对振动悬臂进行非常精确的偏转测量[29] (因此仅在非接触模式下使用)。这种方法很昂贵,只有相对较少的团队使用。
- 扫描隧道显微镜 (STM) –第一台原子显微镜使用了一台配有自己的反馈机制扫描隧道显微镜来测量偏转。[30] 这种方法很难实现,并且与现代方法相比,对偏转变化反应缓慢。
- 光学干涉测量术 –光学干涉测量法可用于测量悬臂偏转。[30] 由于在原子力显微镜中测量的纳米尺度偏转,干涉仪在亚条纹区域运行,因此,激光功率或波长的任何漂移都对测量有很大影响。由于这些原因,必须非常小心地使用非常稳定的激光器进行光学干涉仪测量(例如,在光纤结之间使用折射率匹配流体)。由于这些原因,很少使用光学干涉测量法。
- 电容检测 –金属涂层悬臂可以与悬臂后面的另一个触点形成电容器。[31] 偏转会改变触点之间的距离,可以通过电容变化来测量。
- 压阻检测 –悬臂可以用压阻元件制造,作为应变仪。使用惠斯通电桥,可以测量原子力显微镜悬臂由于偏转而产生的应变。[32] 这在真空应用中并不常用,因为压阻检测会从影响谐振Q的系统中耗散能量。
9 压电扫描仪编辑
原子力显微镜扫描仪由压电材料制成,它与外加电压成比例地膨胀和收缩。它们是伸长还是收缩取决于所施加电压的极性。传统上,尖端或样品安装在由三个压电晶体组成的“三脚架”上,每个压电晶体负责扫描 x,y 和 z 方向。[33] 1986年,在原子力显微镜被发明的同一年,一种新的压电扫描仪,管扫描仪,被开发用于扫描隧道显微镜。[33] 后来管扫描仪被纳入原子力显微镜。试管扫描仪可以在 x, y,和 z 使用具有单个内部触点和四个外部触点的单管压电的方向。与最初的三脚架设计相比,管式扫描器的一个优点是更好的振动隔离,这是由于单个元件结构的更高谐振频率,以及低谐振频率隔离级。缺点是 x-y 运动会导致不必要的 z 导致变形的运动。原子力显微镜扫描仪的另一个流行设计是弯曲台,它对每个轴使用单独的压电,并通过弯曲机构耦合它们。
扫描仪的特征在于它们的灵敏度,即压电运动与压电电压的比率,即压电材料在每一施加电压下延伸或收缩的程度。由于材料或尺寸的不同,不同扫描仪的灵敏度也不同。灵敏度随扫描尺寸非线性变化。压电扫描仪在扫描结束时比在扫描开始时表现出更高的灵敏度。这导致正向和反向扫描行为不同,并在两个扫描方向之间显示滞后现象。 这可以通过向压电电极施加非线性电压以引起线性扫描器移动并相应地校准扫描器来校正。 这种方法的一个缺点是需要重新校准,因为校正非线性运动所需的精确非线性电压将随着压电老化而改变(见下文)。这个问题可以通过在样品台或压电台上添加线性传感器来检测压电的真实运动来解决。传感器可以检测到与理想运动的偏差,并对压电驱动信号进行校正,以校正非线性压电运动。这种设计被称为“闭环”原子力显微镜。无传感器压电原子力显微镜被称为“开环”原子力显微镜。
压电材料的灵敏度随时间呈指数下降。这导致大多数灵敏度变化发生在扫描仪生命的初始阶段。压电扫描仪在出厂前运行大约48小时,这样它们就可以通过灵敏度可能有很大变化的点。随着扫描仪老化,灵敏度将随时间变化较小,并且扫描仪很少需要重新校准,[34] 虽然各种制造商手册建议每月至半月校准开环原子力显微镜。
10 优点和缺点编辑
10.1 优点
原子力显微镜与扫描电子显微镜相比有几个优点。与电子显微镜不同,电子显微镜提供样品的二维投影或二维图像,原子力显微镜提供三维表面轮廓。 此外,原子力显微镜观察的样品不需要任何会不可逆地改变或损坏样品的特殊处理(如金属/碳涂层),并且在最终图像中通常不会受到带电伪影的影响。 电子显微镜需要昂贵的真空环境才能正常工作,而大多数原子力显微镜可以在环境空气甚至液体环境中非常好地工作。 这使得研究生物大分子甚至生物有机体成为可能。 原则上,原子力显微镜可以提供比扫描电镜更高的分辨率。 它已经被证明能在超高真空(UHV)和最近在液体环境中提供真正的原子分辨率。 高分辨率原子力显微镜在分辨率上与扫描隧道显微镜和透射电子显微镜相当。原子力显微镜还可以与各种光学显微镜和光谱学技术相结合,例如红外光谱的荧光显微镜,从而产生扫描近场光学显微镜、纳米傅里叶变换红外光谱并进一步扩展其适用性。原子力显微镜和光学仪器的结合主要应用于生物科学,但最近引起了人们对光伏[35] ,储能研究,[35] 聚合物科学,[36] 纳米技术[37][38] 甚至医学研究[39]的浓厚兴趣
10.2 缺点
与扫描电子显微镜相比,原子力显微镜的缺点之一是扫描图像尺寸单一。在一次扫描中,扫描电镜可以对景深为毫米的平方毫米的区域进行成像,而原子力显微镜只能对最大扫描面积约为150×150微米,最大高度约为10-20微米的区域进行成像。一种改进原子力显微镜扫描区域大小的方法是以类似于千足虫数据存储的方式使用平行探针。
原子力显微镜的扫描速度也是一个限制。传统上,原子力显微镜扫描图像的速度不如扫描电子显微镜快,典型扫描需要几分钟,而扫描电子显微镜能够几乎实时扫描,尽管扫描质量相对较低。原子力显微镜成像过程中相对较慢的扫描速度经常导致图像中的热漂移[40][41][42] 使得原子力显微镜不太适合测量图像上形貌特征之间的精确距离。然而,几个快速动作的设计[43][44] 被建议用来提高显微镜的扫描效率,包括所谓的视频AFM(视频AFM可以以比平均扫描速度更快的视频速率获得合理质量的图像)。为了消除由热漂移引起的图像失真,已经引入了几种方法。[40][41][42]
原子力显微镜图像也可能受到非线性、滞后,[45] 压电材料的蠕变以及 x, y, z 可能需要软件增强和过滤轴的影响。这种过滤可以“展平”真实的形貌特征。然而,较新的原子力显微镜使用实时校正软件(例如,面向特征的扫描[45][40])或闭环扫描仪,这实际上消除了这些问题。一些原子力显微镜还使用分离的正交扫描仪(相对于单个试管),这也有助于消除部分串扰问题。
原子力显微镜与任何其他成像技术一样,存在图像伪影的可能性,这可能是由不合适的尖端、恶劣的操作环境,甚至是样品本身引起的,如右图所示。这些图像伪像是不可避免的;然而,它们的出现和对结果的影响可以通过各种方法减少。由过于粗糙的尖端导致的伪像可能是由于例如不适当的处理或者由于扫描过快或者表面不合理粗糙而与样品发生事实上的碰撞,从而导致尖端的实际磨损。
由于原子力显微镜探头的性质,它们通常不能测量陡峭的墙壁或悬高。 特制的悬臂和原子力显微镜可以用来调节探头的侧面和上下方向(如动态接触和非接触模式),以更昂贵的悬臂、更低的横向分辨率和额外的人为因素为代价来测量侧壁。
11 各种研究领域的其他应用编辑
整合纳米技术和生物研究的最新努力已经取得成功,并对未来显示出很大的希望。由于纳米颗粒是药物传递的潜在载体,细胞对这些纳米颗粒的生物反应正在不断探索,以优化其功效以及如何改进其设计。[45] Pyrgiotakis等人能够通过将工程纳米粒子附着到原子力显微镜尖端研究CeO2 和Fe2O3 工程纳米粒子和细胞之间的相互作用。[46] 研究利用原子力显微镜获得了关于生物介质中活细胞行为的进一步信息。实时原子力光谱学(或纳米拷贝)和动态原子力光谱学已被用于研究活细胞和膜蛋白及其在纳米级高分辨率下的动态行为。成像和获得关于细胞的形貌和性质的信息,也使我们深入了解了通过细胞-细胞相互作用和与其他信号分子(例如,配体)的相互作用发生的化学过程和机制。Evans和Calderwood使用单细胞力显微镜来研究细胞粘附力、结合动力学/动态结合强度及其在细胞信号传导等化学过程中的作用。[47] Scheuring,Lévy和 Rigaud 评论了原子力显微镜探索光合细菌膜蛋白晶体结构的研究。[48]Alsteen等人已经使用基于原子力显微镜的纳米拷贝对活分枝杆菌和抗分枝杆菌药物(特别是异烟肼、乙硫异烟胺、乙胺丁醇和链霉素)之间的相互作用进行了实时分析,[49] 这是通过原子力显微镜对病原体-药物相互作用进行更深入分析的一个例子。
参考文献
- [1]
^Patent US4724318 - Atomic force microscope and method for imaging surfaces with atomic resolution.
- [2]
^"IBM's 35 atoms and the rise of nanotech". CNET (in 英语). Retrieved 2017-08-23..
- [3]
^Binnig, G.; Quate, C. F.; Gerber, C. (1986). "Atomic Force Microscope". Physical Review Letters. 56 (9): 930–933. Bibcode:1986PhRvL..56..930B. doi:10.1103/physrevlett.56.930. PMID 10033323..
- [4]
^Lang, K.M.; D. A. Hite; R. W. Simmonds; R. McDermott; D. P. Pappas; John M. Martinis (2004). "Conducting atomic force microscopy for nanoscale tunnel barrier characterization". Review of Scientific Instruments. 75 (8): 2726–2731. Bibcode:2004RScI...75.2726L. doi:10.1063/1.1777388. Archived from the original on 2013-02-23..
- [5]
^Cappella, B; Dietler, G (1999). "Force-distance curves by atomic force microscopy" (PDF). Surface Science Reports. 34 (1–3): 1–104. Bibcode:1999SurSR..34....1C. doi:10.1016/S0167-5729(99)00003-5. Archived from the original (PDF) on 2012-12-03..
- [6]
^Zhong, Q; Inniss, D; Kjoller, K; Elings, V (1993). "Fractured polymer/silica fiber surface studied by tapping mode atomic force microscopy". Surface Science Letters. 290 (1): L688. Bibcode:1993SurSL.290L.688Z. doi:10.1016/0167-2584(93)90906-Y..
- [7]
^Roiter, Y; Minko, S (Nov 2005). "AFM single molecule experiments at the solid-liquid interface: in situ conformation of adsorbed flexible polyelectrolyte chains". Journal of the American Chemical Society. 127 (45): 15688–9. doi:10.1021/ja0558239. ISSN 0002-7863. PMID 16277495..
- [8]
^Gross, L.; Mohn, F.; Moll, N.; Liljeroth, P.; Meyer, G. (27 August 2009). "The Chemical Structure of a Molecule Resolved by Atomic Force Microscopy". Science. 325 (5944): 1110–1114. Bibcode:2009Sci...325.1110G. doi:10.1126/science.1176210. PMID 19713523..
- [9]
^Giessibl, Franz J. (2003). "Advances in atomic force microscopy". Reviews of Modern Physics. 75 (3): 949–983. arXiv:cond-mat/0305119. Bibcode:2003RvMP...75..949G. doi:10.1103/RevModPhys.75.949..
- [10]
^Hinterdorfer, P; Dufrêne, Yf (May 2006). "Detection and localization of single molecular recognition events using atomic force microscopy". Nature Methods. 3 (5): 347–55. doi:10.1038/nmeth871. ISSN 1548-7091. PMID 16628204..
- [11]
^Ferrari, L.; Kaufmann, J.; Winnefeld, F.; Plank, J. (Jul 2010). "Interaction of cement model systems with superplasticizers investigated by atomic force microscopy, zeta potential, and adsorption measurements". J Colloid Interface Sci. 347 (1): 15–24. Bibcode:2010JCIS..347...15F. doi:10.1016/j.jcis.2010.03.005. PMID 20356605..
- [12]
^Butt, H; Cappella, B; Kappl, M (2005). "Force measurements with the atomic force microscope: Technique, interpretation and applications". Surface Science Reports. 59 (1): 1–152. Bibcode:2005SurSR..59....1B. CiteSeerX 10.1.1.459.3771. doi:10.1016/j.surfrep.2005.08.003..
- [13]
^Gavin M. King; Ashley R. Carter; Allison B. Churnside; Louisa S. Eberle & Thomas T. Perkins (2009). "Ultrastable Atomic Force Microscopy: Atomic-Scale Stability and Registration in Ambient Conditions". Nano Letters. 9 (4): 1451–1456. Bibcode:2009NanoL...9.1451K. doi:10.1021/nl803298q. PMC 2953871. PMID 19351191..
- [14]
^Peter M. Hoffmann; Ahmet Oral; Ralph A. Grimble (2001). "Direct measurement of interatomic force gradients using an ultra-low-amplitude atomic force microscope". Proceedings of the Royal Society A. 457 (2009): 1161–1174. Bibcode:2001RSPSA.457.1161M. CiteSeerX 10.1.1.487.4270. doi:10.1098/rspa.2000.0713..
- [15]
^Radmacher, M. (1997). "Measuring the elastic properties of biological samples with the AFM". IEEE Eng Med Biol Mag. 16 (2): 47–57. doi:10.1109/51.582176. PMID 9086372..
- [16]
^Perkins, Thomas. "Atomic force microscopy measures properties of proteins and protein folding". SPIE Newsroom. Retrieved 4 March 2016..
- [17]
^Galvanetto, Nicola (2018). "Single-cell unroofing: probing topology and nanomechanics of native membranes". Biochimica et Biophysica Acta (BBA) - Biomembranes. 1860 (12): 2532–2538. arXiv:1810.01643. doi:10.1016/j.bbamem.2018.09.019. PMID 30273580..
- [18]
^Roduit, Charles; Sekatski, Serguei; Dietler, Giovanni; Catsicas, Stefan; Lafont, Frank; Kasas, Sandor (2009). "Stiffness Tomography by Atomic Force Microscopy". Biophysical Journal. 97 (2): 674–677. Bibcode:2009BpJ....97..674R. doi:10.1016/j.bpj.2009.05.010. PMC 2711326. PMID 19619482..
- [19]
^Thomas, G.; Y. Ouabbas; P. Grosseau; M. Baron; A. Chamayou; L. Galet (2009). "Modeling the mean interaction forces between power particles. Application to silice gel-magnesium stearate mixtures". Applied Surface Science. 255 (17): 7500–7507. Bibcode:2009ApSS..255.7500T. CiteSeerX 10.1.1.591.1899. doi:10.1016/j.apsusc.2009.03.099..
- [20]
^Sugimoto, Y; Pou, P; Abe, M; Jelinek, P; Pérez, R; Morita, S; Custance, O (Mar 2007). "Chemical identification of individual surface atoms by atomic force microscopy". Nature. 446 (7131): 64–7. Bibcode:2007Natur.446...64S. CiteSeerX 10.1.1.552.6764. doi:10.1038/nature05530. ISSN 0028-0836. PMID 17330040..
- [21]
^Bryant, P. J.; Miller, R. G.; Yang, R.; "Scanning tunneling and atomic force microscopy combined". Applied Physics Letters, Jun 1988, Vol: 52 Issue:26, p. 2233–2235, ISSN 0003-6951..
- [22]
^Oscar H. Willemsen, Margot M.E. Snel, Alessandra Cambi, Jan Greve, Bart G. De Grooth and Carl G. Figdor "Biomolecular Interactions Measured by Atomic Force Microscopy" Biophysical Journal, Volume 79, Issue 6, December 2000, Pages 3267-3281..
- [23]
^Koo-Hyun Chung and Dae-Eun Kim, "Wear characteristics of diamond-coated atomic force microscope probe". Ultramicroscopy, Volume 108, Issue 1, December 2007, Pages 1-10.
- [24]
^Xu, Xin; Raman, Arvind (2007). "Comparative dynamics of magnetically, acoustically, and Brownian motion driven microcantilevers in liquids". J. Appl. Phys. 102 (1): 014303–014303–7. Bibcode:2007JAP...102a4303Y. doi:10.1063/1.2751415..
- [25]
^Hasselbach, K.; Ladam, C. (2008). "High resolution magnetic imaging : MicroSQUID Force Microscopy". Journal of Physics: Conference Series. 97 (1): 012330. Bibcode:2008JPhCS..97a2330H. doi:10.1088/1742-6596/97/1/012330..
- [26]
^Zitzler, Lothar; Herminghaus, Stephan; Mugele, Frieder (2002). "Capillary forces in tapping mode atomic force microscopy". Phys. Rev. B. 66 (15): 155436. doi:10.1103/PhysRevB.66.155436..
- [27]
^Chao Gao. Theory of menisci and its applications. 71..
- [28]
^Giessibl, Franz J. (1 January 1998). "High-speed force sensor for force microscopy and profilometry utilizing a quartz tuning fork" (PDF). Applied Physics Letters. 73 (26): 3956. Bibcode:1998ApPhL..73.3956G. doi:10.1063/1.122948..
- [29]
^Nishida, Shuhei; Kobayashi, Dai; Sakurada, Takeo; Nakazawa, Tomonori; Hoshi, Yasuo; Kawakatsu, Hideki (1 January 2008). "Photothermal excitation and laser Doppler velocimetry of higher cantilever vibration modes for dynamic atomic force microscopy in liquid". Review of Scientific Instruments. 79 (12): 123703–123703–4. Bibcode:2008RScI...79l3703N. doi:10.1063/1.3040500. PMID 19123565..
- [30]
^Rugar, D.; Mamin, H. J.; Guethner, P. (1 January 1989). "Improved fiber-optic interferometer for atomic force microscopy". Applied Physics Letters. 55 (25): 2588. Bibcode:1989ApPhL..55.2588R. doi:10.1063/1.101987..
- [31]
^Göddenhenrich, T. (1990). "Force microscope with capacitive displacement detection". Journal of Vacuum Science and Technology A. 8 (1): 383. doi:10.1116/1.576401..
- [32]
^Giessibl, F. J.; Trafas, B. M. (1 January 1994). "Piezoresistive cantilevers utilized for scanning tunneling and scanning force microscope in ultrahigh vacuum" (PDF). Review of Scientific Instruments. 65 (6): 1923. Bibcode:1994RScI...65.1923G. doi:10.1063/1.1145232..
- [33]
^Binnig, G.; Quate, C. F.; Gerber, Ch. (1986). "Atomic Force Microscope". Physical Review Letters. 56 (9): 930–933. Bibcode:1986PhRvL..56..930B. doi:10.1103/PhysRevLett.56.930. ISSN 0031-9007. PMID 10033323..
- [34]
^R. V. Lapshin (1998). "Automatic lateral calibration of tunneling microscope scanners" (PDF). Review of Scientific Instruments. 69 (9): 3268–3276. Bibcode:1998RScI...69.3268L. doi:10.1063/1.1149091. ISSN 0034-6748..
- [35]
^Geisse, Nicholas A. (July–August 2009). "AFM and Combined Optical Techniques". Materials Today. 12 (7–8): 40–45. doi:10.1016/S1369-7021(09)70201-9..
- [36]
^Pollard, Benjamin; Raschke, Markus B. (2016-04-22). "Correlative infrared nanospectroscopic and nanomechanical imaging of block copolymer microdomains". Beilstein Journal of Nanotechnology (in 英语). 7 (1): 605–612. doi:10.3762/bjnano.7.53. ISSN 2190-4286. PMC 4901903. PMID 27335750..
- [37]
^Huth, F.; Schnell, M.; Wittborn, J.; Ocelic, N.; Hillenbrand, R. (2011). "Infrared-spectroscopic nanoimaging with a thermal source". Nature Materials. 10 (5): 352–356. Bibcode:2011NatMa..10..352H. doi:10.1038/nmat3006. PMID 21499314..
- [38]
^Bechtel, Hans A.; Muller, Eric A.; Olmon, Robert L.; Martin, Michael C.; Raschke, Markus B. (2014-05-20). "Ultrabroadband infrared nanospectroscopic imaging". Proceedings of the National Academy of Sciences (in 英语). 111 (20): 7191–7196. Bibcode:2014PNAS..111.7191B. doi:10.1073/pnas.1400502111. ISSN 0027-8424. PMC 4034206. PMID 24803431..
- [39]
^Paluszkiewicz, C.; Piergies, N.; Chaniecki, P.; Rękas, M.; Miszczyk, J.; Kwiatek, W. M. (2017-05-30). "Differentiation of protein secondary structure in clear and opaque human lenses: AFM – IR studies". Journal of Pharmaceutical and Biomedical Analysis. 139: 125–132. doi:10.1016/j.jpba.2017.03.001. PMID 28279927..
- [40]
^R. V. Lapshin (2004). "Feature-oriented scanning methodology for probe microscopy and nanotechnology" (PDF). Nanotechnology. 15 (9): 1135–1151. Bibcode:2004Nanot..15.1135L. doi:10.1088/0957-4484/15/9/006. ISSN 0957-4484..
- [41]
^R. V. Lapshin (2007). "Automatic drift elimination in probe microscope images based on techniques of counter-scanning and topography feature recognition" (PDF). Measurement Science and Technology. 18 (3): 907–927. Bibcode:2007MeScT..18..907L. doi:10.1088/0957-0233/18/3/046. ISSN 0957-0233..
- [42]
^V. Y. Yurov; A. N. Klimov (1994). "Scanning tunneling microscope calibration and reconstruction of real image: Drift and slope elimination". Review of Scientific Instruments. 65 (5): 1551–1557. Bibcode:1994RScI...65.1551Y. doi:10.1063/1.1144890. ISSN 0034-6748. Archived from the original (PDF) on 2012-07-13..
- [43]
^G. Schitter; M. J. Rost (2008). "Scanning probe microscopy at video-rate". Materials Today. 11 (special issue): 40–48. doi:10.1016/S1369-7021(09)70006-9. ISSN 1369-7021. Archived from the original (PDF) on September 9, 2009..
- [44]
^R. V. Lapshin; O. V. Obyedkov (1993). "Fast-acting piezoactuator and digital feedback loop for scanning tunneling microscopes" (PDF). Review of Scientific Instruments. 64 (10): 2883–2887. Bibcode:1993RScI...64.2883L. doi:10.1063/1.1144377. ISSN 0034-6748..
- [45]
^R. V. Lapshin (1995). "Analytical model for the approximation of hysteresis loop and its application to the scanning tunneling microscope" (PDF). Review of Scientific Instruments. 66 (9): 4718–4730. Bibcode:1995RScI...66.4718L. doi:10.1063/1.1145314. ISSN 0034-6748. (Russian translation is available)..
- [46]
^Pyrgiotakis, Georgios; Blattmann, Christoph O.; Demokritou, Philip (10 June 2014). "Real-Time Nanoparticle-Cell Interactions in Physiological Media by Atomic Force Microscopy". ACS Sustainable Chemistry & Engineering (Sustainable Nanotechnology 2013): 1681–1690..
- [47]
^Evans, Evan A.; Calderwood, David A. (25 May 2007). "Forces and Bond Dynamics in Cell Adhesion". Science. 316 (5828): 1148–1153. Bibcode:2007Sci...316.1148E. doi:10.1126/science.1137592. PMID 17525329..
- [48]
^Scheuring, Simon; Lévy, Daniel; Rigaud, Jean-Louis (1 July 2005). "Watching the Components". Biochimica et Biophysica Acta (BBA) - Biomembranes. 1712 (2): 109–127. doi:10.1016/j.bbamem.2005.04.005. PMID 15919049..
- [49]
^Alsteens, David; Verbelen, Claire; Dague, Etienne; Raze, Dominique; Baulard, Alain R.; Dufrêne, Yves F. (April 2008). "Organization of the Mycobacterial Cell Wall: A Nanoscale View". Pflügers Archiv: European Journal of Physiology. 456 (1): 117–125. doi:10.1007/s00424-007-0386-0. PMID 18043940..
暂无