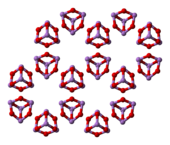三氧化二砷
编辑三氧化二砷是一种无机化合物, 其化学式 为As2O3。它是一种种商业上重要的砷氧化物,是包括有机砷化合物在内的其他砷化合物的主要前体,每年生产约50,000吨。 鉴于砷化合物的高毒性,有关它的许多应用都有争议。
1 应用编辑
三氧化二砷的大规模应用包括作林业产品的前体、无色玻璃生产和电子产品方面。[1] 它作为砷的主要化合物,是元素砷、砷合金和砷半导体的前体。有机砷化合物,如饲料添加剂(硝羟苯胂酸)和药物(新胂凡纳明),都是三氧化二砷的衍生物。块状砷基化合物亚砷酸钠和卡可基酸钠也来自于三氧化二砷。
三氧化二砷及衍生物的很多应用是基于砷的毒性,比如使用氧化物作为木材防腐剂。砷酸铜是三氧化二砷的一种衍生物,它在美国和马来西亚被大规模用作木材防腐剂,但在世界许多地方这是被禁止使用的。这种做法目前仍有争议。[1] 通过与三氧化二乙酸乙酯结合,可以生产一种被称为巴黎绿的有活力的颜料,可用于油漆和杀鼠剂,但目前这应用已经被叫停。
1.1 医疗应用
尽管砷具有众所周知的毒性,但是三氧化二砷早就引起了生物医学的兴趣,这可以追溯到中医,它在中医中被称为:砒霜,目前仍然在治疗癌症和其他疾病中使用,[1]还应用在顺势疗法中,三氧化二砷被为砷酸。一些受到质疑的专利药物,例如福勒溶液,也含有氧化砷的衍生物。[2]
20世纪70年代,中国研究员张廷栋及其同事研究了用传统中药三氧化二砷治疗急性早幼粒细胞白血病的潜在用途。[3] 基于他的研究,中国和西方的研究最终开发了三烯酮药物,该药物由宝丽来生物制药有限公司开发,并于2000年被美国食品和药物管理局批准用于白血病治疗,随后在被三尖杉公司收购之前由细胞治疗有限公司营销和销售。[4] 三氧化二砷,商品名为Trisenox(制造商:Teva收购的三尖杉酯碱),是美国食品和药物管理局批准用于治疗对“一线”药物即全反式维甲酸(ATRA)无反应的急性早幼粒细胞白血病的化疗药物。临床已证明三氧化二砷具有诱导癌细胞凋亡的功能。但是由于砷的毒性,这种药物有很大的风险。它还可以用作急性髓系白血病难治性早幼粒细胞(M3)亚型的细胞抑制剂。[5][6] 三氧化二砷和全反式维甲酸(ATRA)的联合疗法已被美国食品和药物管理局(FDA)批准用于治疗某些白血病。[7]目前,香港大学已经开发了一种可以口服的液态三氧化二砷。[8]
2 毒理学编辑
三氧化二砷容易被消化系统吸收:吸入或皮肤接触时的毒性效应也是广为人知的。通过把它甲基化为单甲基胂酸和二甲基胂酸,成为尿液中排泄物,最初它被很快地代谢掉(半衰期为1-2天),但会有一定的残余量(30-40%的残余量)被吸附到骨骼、肌肉、皮肤、头发和指甲(所有富含角蛋白的组织)中,并在数周或数月内消除。
摄入急性砷中毒的第一个症状是消化功能出现问题:呕吐、腹痛、腹泻通常伴有出血。亚致死剂量会导致抽搐、心血管问题、肝脏和肾脏炎症以及血液凝固异常。接下来的症状是指甲上出现典型的白线和脱发。较低的剂量会导致肝脏和肾脏问题以及皮肤颜色变化。即使三氧化二砷的稀溶液接触眼睛也是危险的。
三氧化二砷的毒性具有传奇性,也是大量文学创作的主题。[9][10][11]
慢性砷中毒被称为地方砷中毒。这种疾病影响冶炼厂的工人、饮用水中砷含量高(0.3-0.4 ppm)的人群以及长期服用含砷药物的患者。同样,对美国、日本和瑞典铜铸造厂工人的研究表明,与普通人群相比,接触砷最多的工人患肺癌的风险高6-10倍。饮用水中或作为医疗手段长期摄入三氧化二砷可能导致皮肤癌。一项对接触三氧化二砷粉尘的妇女进行的研究也指出了生殖问题(流产率高、出生体重低、先天畸形)。
在奥地利,生活着所谓的“施第里尔吃砷者”,他们摄入的剂量远远超过三氧化二砷的致死剂量,没有任何明显的伤害。砷的摄入被认为可以在高海拔地区从事艰苦的工作,例如在阿尔卑斯山。[12][13][14][15]
在美国,职业安全与健康管理局对呼吸区空气中无机砷化合物的职业允许接触限值为0.010毫克/立方米。
3 生产编辑
4 性质和反应编辑
三氧化二砷是一种两性氧化物,其水溶液呈弱酸性。因此,它容易溶解在碱性溶液中,生成亚砷酸盐。它不太溶于酸,尽管它会溶于盐酸。[19]
用无水氟化氢和氯化氢参与反应,得到三氯化砷和三氯化砷:[20]
- As 2O 3 + 6 HX → 2 AsX 3 + 3 H 2O (X = F, Cl) 只有用强氧化剂如臭氧、过氧化氢和硝酸,它才能产生五氧化二砷或其相应的酸: [20]
- 2 HNO 3+ As 2O 3+ 2 H 2O → 2 H 3AsO 4+ N 2O 3 就抗氧化性而言,三氧化二砷不同于容易燃烧成五氧化二磷的三氧化二磷。 三氧化砷的还原产生单质砷或砷化氢(AsH3),具体取决于反应条件: [20]
As2O3+6 Zn+12 HNO3→2 AsH3+6 Zn(NO3)2+3 H2O
该反应用于Marsh试验。
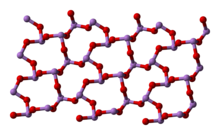
5 结构编辑
6 环境问题编辑
冶炼和相关矿石加工经常产生三氧化二砷,这会对环境构成严重风险。例如,加拿大的巨型矿加工了大量毒砂污染的金矿。
参考文献
- [1]
^Gielen, M.; Tiekink, E. R. (2005). Metallotherapeutic Drugs and Metal-Based Diagnostic Agents. Wiley. p. 298. ISBN 0-470-86403-6..
- [2]
^Gibaud, S.; Jaouen, G. (2010). "Arsenic-Based Drugs: From Fowler's Solution to Modern Anticancer Chemotherapy". Topics in Organometallic Chemistry. Topics in Organometallic Chemistry. 32: 1–20. doi:10.1007/978-3-642-13185-1_1. ISBN 978-3-642-13184-4..
- [3]
^Rao Y, Li R, Zhang D (June 2013). "A drug from poison: how the therapeutic effect of arsenic trioxide on acute promyelocytic leukemia was discovered". Sci China Life Sci. 56 (6): 495–502. doi:10.1007/s11427-013-4487-z. PMID 23645104..
- [4]
^Bian Z, Chen S, Cheng C, Wang J, Xiao H, Qin H (2012). "Developing new drugs from annals of Chinese medicine". Acta Pharmaceutica Sinica B. 2: 1. doi:10.1016/j.apsb.2011.12.007..
- [5]
^Soignet, S. L.; Frankel, S. R.; Douer, D.; Tallman, M. S.; Kantarjian, H.; Calleja, E.; Stone, R. M.; Kalaycio, M.; Scheinberg, D. A.; et al. (2001). "United States Multicenter Study of Arsenic Trioxide in Relapsed Acute Promyelocytic Leukemia" (pdf). Journal of Clinical Oncology. 19 (18): 3852–3860. PMID 11559723..
- [6]
^Antman, K. H. (2001). "Introduction: The history of arsenic trioxide in cancer therapy" (pdf). Oncologist. 6 (Supplement 2): 1–2. doi:10.1634/theoncologist.6-suppl_2-1. PMID 11331433..
- [7]
^Zhu, J.; Chen, Z.; Lallemand-Breitenbach, V.; De Thé, H. (2002). "How acute promyelocytic leukaemia revived arsenic". Nature Reviews Cancer. 2 (9): 705–714. doi:10.1038/nrc887. PMID 12209159..
- [8]
^Au, W.-Y.; Kumana, C. R.; Kou, M.; Mak, R.; Chan, G. C.; Lam, C.-W.; Kwong, Y.-L. (2003). "Oral arsenic trioxide in the treatment of relapsed acute promyelocytic leukemia" (pdf). Blood. 102 (1): 407–408. doi:10.1182/blood-2003-01-0298. PMID 12814916..
- [9]
^"Stanton v Benzler 9716830". U.S. 9th Circuit Court of Appeals. 1998-06-17. Retrieved 2008-06-09. (...) convicted by a jury of first degree murder for poisoning her ex-husband. Her ex-husband's body was found with traces of arsenic trioxide in it..
- [10]
^Emsley, J. (2006). "Arsenic". The Elements of Murder: A History of Poison. Oxford University Press. pp. 93–197. ISBN 978-0-19-280600-0..
- [11]
^Flaubert, G. (1856). Madame Bovary..
- [12]
^"Arsenic Eaters". New York Times. July 26, 1885..
- [13]
^Allesch, R. M. (1959). Arsenik. Seine Geschichte in Österreich. Archiv für vaterländische Geschichte und Topographie. 54. Klagenfurt: Kleinmayr..
- [14]
^Przygoda, G.; Feldmann, J.; Cullen, W. R. (2001). "The arsenic eaters of Styria: a different picture of people who were chronically exposed to arsenic". Applied Organometallic Chemistry. 15 (6): 457–462. doi:10.1002/aoc.126..
- [15]
^Whorton, J. C. (2010). The Arsenic Century. Oxford University Press. pp. 270–273. ISBN 978-0-19-960599-6..
- [16]
^Grund, S. C.; Hanusch, K.; Wolf, H. U. (2005), "Arsenic and Arsenic Compounds", Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, doi:10.1002/14356007.a03_113.pub2.
- [17]
^Garavelli et al. 2013, http://www.minsocam.org/msa/ammin/toc/Abstracts/2013_Abstracts/FM13_Abstracts/Garavelli_p470_13.pdf.
- [18]
^Kampf et al. 2013, http://minmag.geoscienceworld.org/content/78/3/747.abstract.
- [19]
^Greenwood, N. N.; & Earnshaw, A. (1997). Chemistry of the Elements (2nd Edn.), Oxford:Butterworth-Heinemann. ISBN 0-7506-3365-4..
- [20]
^Handbook of Preparative Inorganic Chemistry, 2nd Ed. Edited by G. Brauer, Academic Press, 1963, NY..
- [21]
^Holleman, A. F.; Wiberg, E. (2001). Inorganic Chemistry. San Diego: Academic Press. ISBN 0-12-352651-5..
暂无