NF-κB
编辑目录编辑
2 结构编辑
NF-κB家族的所有蛋白质在其N-端共享一个Rel同源结构域。NF-κB蛋白的一个亚家族,包括RelA、RelB和c-Rel在内,在其C端有一个反式激活结构域。相反,NF-κB1和NF-κB2蛋白被合成为大的前体p105和p100,它们经过加工分别产生成熟的NF-κB亚基p50和p52。p105和p100的加工是由泛素/蛋白酶体途径介导的,包括选择性降解它们含有锚蛋白重复序列的C-端区域。p100产生p52是一个严格调节的过程,而p50是由p105的组成型加工产生的。[7][8] p50和p52蛋白没有激活转录的内在能力,因此被认为在以同源二聚体结合κB元件时充当转录阻遏物。[9][10] 事实上,这个观点证明了p105敲除研究的解释有误,在该研究中,利用基因操作敲除一个IκB(全长p105)和一个可能的阻遏物(p50同源二聚体),另外还除去转录激活因子(RelA-p50异源二聚体)。
3 成员编辑
NF-κB家族成员与逆转录病毒癌蛋白v-Rel具有结构同源性,因此被归类为NF-κB/Rel蛋白。[11]
哺乳动物NF-κB家族有五种蛋白质:[11]
| 类型 | 蛋白质 | 别名 | 基因 |
|---|---|---|---|
| I | NF-κB1 | p105 → p50 | NFKB1 |
| NF-κB2 | p100 → p52 | NFKB2 | |
| II | RelA | p65 | RELA |
| RelB | RELB | ||
| c-Rel | REL |
以下是五个人类NF-κB家族成员:
| NFKB1 | |
|---|---|
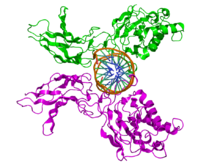
| NF-KB1蛋白(绿色和品红色)同源二聚体与脱氧核糖核酸(棕色)结合的晶体结构俯视图(PDB: 1SVC)。 | |
| 识别 | |
| 符号 | NFKB1 |
| Entrez | 4790 |
| HUGO | 7794 |
| OMIM | 164011 |
| RefSeq | NM_003998 |
| UniProt | P19838 |
| 其他资料 | |
| 基因座 | 4 q24 |
| RELA | |
|---|---|
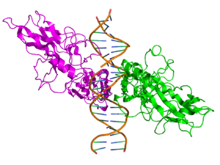
| 与脱氧核糖核酸(棕色)结合的RELA蛋白(绿色和品红色)同源二聚体晶体结构(PDB: 2RAM)的侧视图。 | |
| 识别 | |
| 符号 | RELA |
| Entrez | 5970 |
| HUGO | 9955 |
| OMIM | 164014 |
| RefSeq | NM_021975 |
| UniProt | Q04206 |
| 其他资料 | |
| 基因座 | 11 q13 |
| NFKB2 | |
|---|---|
| 识别 | |
| 符号 | NFKB2 |
| Entrez | 4791 |
| HUGO | 7795 |
| OMIM | 164012 |
| RefSeq | NM_002502 |
| UniProt | Q00653 |
| 其他资料 | |
| 基因座 | 10 q24 |
| RELB | |
|---|---|
| 识别 | |
| 符号 | RELB |
| Entrez | 5971 |
| HUGO | 9956 |
| OMIM | 604758 |
| RefSeq | NM_006509 |
| UniProt | Q01201 |
| 其他资料 | |
| 基因座 | 19 q13.2-19q13 |
| REL | |
|---|---|
| 识别 | |
| 符号 | REL |
| Entrez | 5966 |
| HUGO | 9954 |
| OMIM | 164910 |
| RefSeq | NM_002908 |
| UniProt | Q04864 |
| 其他资料 | |
| 基因座 | 2 p13-p12 |
4 物种分布和进化编辑
5 信号转导编辑
5.1 激活效应
NF-κB在细胞响应调节中很重要,因为它属于“短效”初级转录因子的范畴,即它是非激活态细胞中存在的转录因子,并且不需要合成新的蛋白质(该家族的其他成员包括转录因子,如c-Jun、STATs和核激素受体)以激活其功能。这使得NF-κB成为有害细胞刺激的首要响应蛋白。已知的NF-κB活性诱导剂是高度可变的,包括活性氧 (ROS)、肿瘤坏死因子α (TNF-α)、白细胞介素1β(IL-1β)、细菌脂多糖 (LPS)、异丙肾上腺素、可卡因和电离辐射。[14]
NF-κB受体激活蛋白(RANK)是肿瘤坏死因子受体的一种,是NF-κB的主要活化因子。骨保护素(OPG)是RANK配体(RANKL)的诱饵受体同系物,通过与RANKL结合抑制RANK,因此,骨保护素参与了NF-κB激活的严密调节。[15]
许多细菌产物和多种细胞表面受体的刺激导致NF-κB活化和快速的基因表达变化。[16] Toll样受体 (TLRs)作为特定模式识别分子的确定以及对TLRs的刺激导致NF-κB激活的发现,提高了我们对不同病原体如何激活NF-κB的认识。例如,研究已经确定TLR4是革兰氏阴性菌脂多糖组分的受体。[16] TLR是先天免疫应答和适应性免疫应答的关键调节因子。[17]
与RelA、RelB和c-Rel不同,p50和p52 NF-κB亚基在它们的C端部分没有反式激活结构域。然而,p50和p52 NF-κB成员在调节NF-κB功能的特异性中起着关键作用。尽管p50和p52的同源二聚体通常是κB位点转录的阻遏物,但是,p50和p52都可通过与Rel、RelB或c-Rel形成异源二聚体参与相关靶基因的反式激活。[18] 此外,p50和p52同源二聚体也与核蛋白Bcl-3结合,它们所形成的复合物具有转录激活因子的功能。[19][20][21]
5.2 抑制作用
在未受刺激的细胞中,NF-κB二聚体被一个叫做IκBs(κB抑制蛋白)的抑制因子家族隔离在细胞质中。IκBs是一种含有多个被称为锚蛋白重复序列的蛋白质。凭借着这样的锚蛋白重复结构域,IκB蛋白掩盖了NF-κB蛋白的核定位信号(NLS),并使核转录因子κB以非活性状态被隔离在细胞质中。[22]
IκBs是一个相关蛋白家族,有一个N-端调节结构域,其后有六个或更多锚蛋白重复序列和一个靠近其C-端的PEST结构域。虽然IκB家族由IκBα、IκBβ、IκBε和Bcl-3组成,但研究得最透彻且主要的IκB蛋白是IκBα。p105和p100也起着IκB蛋白的作用,是由于其C-端部分也具有锚蛋白重复出现的结构。p100的C-端部分,通常称为IκBδ,具有抑制因子的作用。[23][24] IκBδ的降解作用是为了响应发育信号(如受到LTβ受体的转导作用)的刺激,增强了NF-κB二聚体对非典型的NIK依赖途径的激活作用。[23][25]
5.3 激活过程(典型的/经典的)
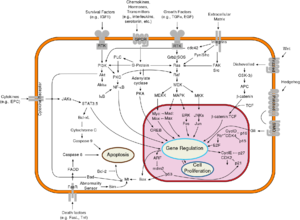
NF-κB的激活是由信号诱导的IκB蛋白降解引起的。这主要是通过激活一种叫做IκB激酶的激酶(IKK)来实现的。IKK由催化IKKα和IKKβ亚基的异源二聚体和称为NEMO (NF-κB必需调节因子) 或IKKγ 的“主”调节蛋白组成。当被通常来自细胞外部的信号激活时,IκB激酶使位于IκB调节结构域的两个丝氨酸残基磷酸化。当在这些丝氨酸上发生磷酸化时(例如,人IκBα中的32位和36位丝氨酸),IκB蛋白被泛素化过程修饰,进而IκB蛋白被称为蛋白酶体的细胞结构降解。
随着IκB的降解,NF-κB复合物随后被释放进入细胞核,在那里它可以“开启”附近具有NF-κB结合位点的特定基因的表达。NF-κB对这些基因的激活引起了特定的生理反应,例如炎症或免疫反应、细胞存活反应或细胞增殖。NF-κB向细胞核的转移可用免疫细胞化学方法检测,并用激光扫描细胞仪测定。[26]NF-κB开启其自身阻遏物IκBα的表达。然后,新合成的IκBα可以重新抑制NF-κB,并因此形成自动反馈回路,从而导致NF-κB活性水平的波动。[27] 此外,包括艾滋病HIV病毒在内的几种病毒都有NF-κB的结合位点,NF-κB得以控制病毒基因的表达,进而促进病毒复制或病毒致病性。在感染了HIV-1的情况下,NF-κB的激活至少可能参与了部分病毒从潜伏的、非活跃状态到激活状态的转变。[28] YopP是鼠疫耶尔森氏菌分泌的因子,是鼠疫的病原体,它可阻止IκB的泛素化。这使得该病原体对NF-κB途径进行有效的抑制,从而阻断人感染耶尔森氏菌后的免疫反应。[29]
5.4 NF-κB活性抑制因子
与NF-κB活性有关的已知蛋白抑制因子,其中一个是IFRD1,它通过促进HDAC3至p65的募集,增强p65亚基在310位赖氨酸进行HDAC介导的去乙酰化,从而抑制NF-κB p65的活性。事实上,IFRD1与p65和HDAC3形成三分子复合物。[30][31]
NAD+依赖的蛋白去乙酰化酶和长寿因子SIRT1通过在NF-kB的RelA/p65亚基的第310位赖氨酸去乙酰化来抑制NF-κB基因表达。[32]
5.5 非典型的/可替代的途径
一类特定的细胞分化或发育刺激,可激活非典型NF-κB途径,在细胞核中诱导NF-κB/RelB:p52二聚体的产生,如淋巴毒素β受体、BAFF或RANKL。在这一途径中,受体结合时NF-κB诱导激酶(NIK)的激活导致NF-κB2前体蛋白p100磷酸化并随后以IKK1/IKKa依赖蛋白酶体加工方式变为成熟p52亚单位。然后p52与RelB二聚化产生核RelB:p52 与DNA结合活性,并调节一类独特的基因。[33] 与依赖NEMO-IKK2介导的κBα,-β,-ε降解的典型信号途径相反,非典型信号途径主要依赖于NIK介导的p100加工为p52的过程。鉴于这两条途径利用了完全不同的调控方式,它们被认为是相互独立的。然而,最近的分析显示,非典型途径的成分,即RelB和p52的合成,受到典型的IKK2-IκB-RelA:p50信号途径控制。此外,细胞环境中典型途径的二聚体和非典型途径的二聚体,即RelA:p50和RelB:p52的产生具有机制上的关联。[34] 此外,细胞环境中典型途径的二聚体和非典型途径的二聚体,即RelA:p50和RelB:p52的产生具有机制上的关联。[34] 这些分析表明,完整的NF-κB系统网络构成了激活包含RelA和RelB的二聚体的基础,功能失常的典型途径也将通过非典型途径引发异常细胞应答。
5.6 免疫作用
NF-κB是一种重要的转录因子,它可调控参与先天及获得性免疫应答过程的基因表达。[35] 一旦T细胞或B细胞受体被激活,NF-κB就通过前述的不同信号途径的成分被激活。在配体结合T细胞受体后,蛋白激酶Lck被募集并磷酸化CD3位于胞质的尾部ITAMs区域。随即ZAP70被招募到磷酸化的ITAMs区域,并帮助募集LAT和PLC-γ,该过程导致PKC活化。通过上述的一系列磷酸化事件,激酶复合体被激活,并且NF-κB能够进入细胞核,上调与T细胞发育、成熟和增殖相关基因的表达水平。[36]
5.7 在神经系统中的作用
除了在调节细胞存活中的作用外,马克·马特森和其他人的研究表明,NF-κB在神经系统中具有多种功能,包括可塑性、学习和记忆方面的作用。除了其他组织中激活的NF-κB的刺激因子外,神经系统中的NF-κB还可以被生长因子(BDNF-,NGF)和突触传递如谷氨酸激活。[37] 神经系统中的这些NF-κB激活因子都集中在IKK复合体和经典信号途径上。
最近,人们对NF-κB在神经系统中的作用产生了极大的兴趣。目前的研究表明,NF-κB对包括螃蟹、[37][37] 果蝇,[37] 和小鼠在内的多种生物的学习和记忆非常重要。[37][38] NF-κB可能通过调节突触可塑性、[38][38] 突触功能,[37][39][40] 以及通过调节 树突[41] 和树突棘的生长[40]来部分调节学习和记忆。
具有NF-κB结合位点的基因在学习后表达增加,[38]表明神经系统中NF-κB的转录靶点对神经元可塑性很重要。包括生长因子(BDNF-,神经生长因子),[42] 细胞因子(肿瘤坏死因子-α, 肿瘤坏死因子受体)[43] 和激酶(PKAc)在内的多种NF-κB靶基因可能对神经元可塑性及神经元学习具有重要作用。[38]
尽管有功能的证据表明Rel家族转录因子在神经系统中发挥作用,但尚不清楚NF-κB对神经系统的影响是否反映它对神经元的转录激活作用。目前大多数实验操作和分析是在生物体内所发现的混合细胞环境中进行的,即在含有大量神经胶质的“神经元”细胞培养物中进行实验,或在肿瘤衍生的“神经元”细胞系中进行研究。当转染或其他操作已经特异地靶向到神经元时,实验测量的指标通常是经典的电生理现象或与基因转录毫不相关的其他参数。在高度纯化的神经元培养物中对NF-κB依赖性转录进行细致的研究,通常只有少量或没有NF-κB活性被检测到。[44][45]一些关于神经元中NF-κB功能的报道似乎是抗体特异性不足造成的假阳性结果。[46]当然,细胞培养的假阳性——例如,从神经胶质细胞的作用中去除神经元——也会产生虚假的结果。但这种假阳性问题已经在至少两种共培养方法中得到解决。Moerman等人[47] 使用了共培养的方式,通过这种方式,在进行处理后神经元和神经胶质细胞可被分离而用于EMSA分析实验,他们发现受谷氨酸刺激诱导的NF-κB仅存于神经胶质细胞中(有趣的是,只有与神经元共存48小时的神经胶质细胞才具有这样的功能)。同样的研究者用另一种方法探索了这个问题,利用了NF-κB报告基因转基因小鼠的神经元与野生型胶质细胞共同培养;谷氨酸刺激物仍不能在神经元中激活NF-κB。[48] 在某些条件下(特别是被报道为组成型的条件下)发现的一些DNA结合活性似乎是由Sp3和Sp4与神经元中一组κB增强子序列结合而产生的。[49] 这种活性实际上受到谷氨酸盐和其他可升高神经元内钙信号的条件的抑制。总之,NF-κB在神经元中的作用仍然是不确定的,因为很难在测定细胞的转录情况的同时将转录细胞的类型也鉴定出来。当然,学习和记忆的过程可能会受到星形胶质细胞和其他胶质细胞成分中转录变化情况的影响。我们应该想到,除了基因的直接反式激活作用之外,NF-κB还可能有许多其他的机制作用。
6 临床意义编辑
6.1 癌症
NF-κB是广泛存在于真核细胞中的一种控制细胞增殖和细胞存活基因表达的调节因子。 因此,许多不同类型的人类肿瘤都有错误调节的NF-κB:即NF-κB是组成性激活的。活性NF-κB打开了基因表达的开关,这些受调控的基因可以维持细胞增殖并保护细胞免受除此以外能够引起细胞凋亡而引起的细胞死亡的外界条件的影响。在癌症中,控制NF-κB信号的蛋白质发生突变或异常表达,导致恶性细胞和机体其他部分之间的协调缺陷。以上情况在癌细胞转移和免疫系统对肿瘤的无效清除中都很常见。[50] 正常细胞可能在从其所属组织中取出后死亡,或者当其基因组不能与组织功能协调运行时死亡:正常细胞的这些过程都依赖于NF-κB的反馈调节,而在癌症中缺乏相关过程的调节作用。[51]
NF-κB的功能缺陷增加了细胞凋亡的易发性,从而导致细胞死亡增多。这是因为NF-κB可调节抗凋亡基因的表达,尤其是TRAF1和TRAF2的表达,进而抑制作为大多数凋亡过程中核心蛋白分子的半胱氨酸天冬氨酸特异性蛋白酶(caspase)家族的活性。[52]
在肿瘤细胞中(例如,在41%的鼻咽癌中[53]),由于编码NF-κB转录因子的基因或控制NF-κB活性的基因(如IκB基因)的突变造成了NF-κB具有活性;此外,一些肿瘤细胞可以分泌引起NF-κB活化的因子。阻断NF-κB的功能可使肿瘤细胞停止增殖、肿瘤细胞死亡或对增加肿瘤细胞对抗肿瘤药物的作用的敏感性。因此,在各大制药公司以抗癌治疗为目标的多个积极研究中,NF-κB是主要的研究对象。[54]
尽管令人信服的实验数据已经确定NF-κB是肿瘤发生的关键促进物质,这为基于抑制NF-κB活性的抗肿瘤治疗的发展创造了坚实的理论基础,但是由于有数据显示NF-κB的活性也能增加肿瘤细胞对凋亡和衰老信号的敏感度,因此应当谨慎考虑在癌症治疗中广泛使用抗NF-κB活性的治疗策略。另外,有证据表明典型信号通路中的NF-κB是Fas蛋白转录激活因子,而另一种非典型信号通路的NF-κB是Fas蛋白的转录抑制因子。[55]所以,NF-κB可以促进癌细胞中Fas蛋白介导的凋亡过程,因此抑制NF-κB的活性可能抑制Fas介导的凋亡,从而削弱宿主免疫细胞介导的肿瘤抑制过程。
6.2 炎症反应
因为NF-κB控制着许多炎症相关基因,所以NF-κB长期活跃在许多炎症性疾病中是不足为奇的,例如炎症性肠病、关节炎、败血症、胃炎、哮喘、动脉粥样硬化[56] 等。值得注意的是,尤其是心血管疾病中,某些NF-κB激活因子,如骨保护素(OPG) 活性的升高,与死亡率升高有关。[57][58] NF-κB升高也与精神分裂症有关。[59] 最近,NF-κB的激活被认为是香烟烟雾在骨骼肌中分解代谢作用和少肌症的可能分子机制。[60]研究表明,在炎症过程中,细胞的功能依赖于它与邻近细胞接触时和与激素结合时激活的信号,尤其是通过特定受体作用于它的细胞因子。[61] 组织内的细胞表型通过反馈信号的相互刺激而建立,这种反馈信号是可以与其他细胞协调其功能;由于在反馈作用的过程中,细胞改变表型,并逐步表达一系列的与消除炎症后的组织再生相关的基因组合,因此,当组织受到炎症感染时,反馈作用在细胞功能的重新编程过程中尤为显著。[61][62] 那些在组织中常驻的细胞和免疫系统的循环细胞之间产生的反馈反应尤其重要。[62] 不同细胞类型和免疫系统之间反馈反应的保真度取决于限制由NF-κB激活的基因范围的机制的完整性,该机制只允许有助于有效免疫应答的基因进行表达,并随后在炎症解决后完全恢复组织功能。[62] 在癌症中,调节基因的表达以响应炎症刺激的机制受到改变,其改变的程度是:细胞不再将自身的存活与其表型及剩余部分组织的协调机制联系起来。[51] 上述机制的改变在NF-κB活性调节严重受损时非常明显,此时的NF-κB允许癌细胞表达异常的NF-κB靶基因群。[63] 这不仅导致癌细胞功能异常:周围组织中的细胞也改变了它们的功能,不再专一地支持生物的存活。此外,癌症微环境中的几种类型的细胞可以改变它们的表型以支持癌细胞生长。[64][65][66] 因为炎症发生时需要不同类型的细胞之间的基因协同表达以使组织再生,所以炎症反应是一个检验组织成分保真度的过程。[61][67]
6.3 NEMO综合症
NEMO缺乏综合征是一种罕见的遗传疾病,与IKBKG蛋白的缺陷有关,该缺陷转而可激活NF-kB。它主要影响男性,并有一系列高度可变的症状和预后。[68]
6.4 依赖性
NF-κB是ΔFosB的几个诱导转录靶蛋白之一,其促进对刺激依赖的发展和维持。[69] 在尾壳核中,NF-κB的诱导与运动增加有关,而在伏隔核中,NF-κB的诱导通过鼓励致敏作用增强药物的正向强化效应。
| 目标 基因 |
|
神经效应 | 行为效应 | |
|---|---|---|---|---|
| c-Fos | ↓ | 可以缓慢的诱导FosB 的分子开关 | – | |
| 强啡肽 | ↓ |
κ-阿片反馈回路下调 | 增加药物奖励 | |
| NF-κB | ↑ | NAcc树枝状突起的扩展 NAcc中的NF-κB炎症反应 慢性胰腺炎中的NF-κB炎症反应 |
增加药物奖励 增加药物奖励 运动敏化 |
|
| GluR2 | ↑ | 对谷氨酸盐敏感性降低 | 增加药物奖励 | |
| Cdk5 | ↑ | GluR1突触蛋白磷酸化 NAcc树枝状突起的扩展 |
药物奖励减少 (净效应) |
7 非药物抑制剂编辑
8 作为药物作用的靶点编辑
在许多癌症中经常观察到NF-κB的异常激活。此外,抑制NF-κB可以限制癌细胞的增殖。NF-κB还是炎症反应中的关键因子。因此抑制NF-κB信号的方法在癌症和炎症性疾病中具有潜在的治疗应用。[76][77]
NF-κB核转运的激活可以与氧化应激的升高分开[78],这一发现为靶向抑制NF-κB的策略提供了一条有希望的发展途径。
一种名为denosumab的新药在多个患者亚组中都可以通过抑制RANKL来提高骨密度和降低骨折率。RANKL通过其受体RANK发挥作用,受体RANK反过来促进NF-κB,[79]RANKL通常通过促进单核细胞分化来为破骨细胞发挥作用。
二硫化物、奥美沙坦和二硫代氨基甲酸酯能抑制NF-κB信号级联。[80] 开发NF-kB的直接抑制剂的努力随着化合物如(-)-双氢甲氧基甲烷、PBS-1086、IT-603和IT-901的出现而出现。[81][82][83](-)-双氢甲基醚和聚苯乙烯-1086是NF-κB的不可逆结合剂,而IT-603和IT-901是其可逆的结合剂,DHMEQ可共价结合到p65的38位半胱氨酸。[84]
据称,阿那他滨的抗炎作用是由调节NF-κB活性引起的。[85] 然而,声称其益处的研究使用了毫摩尔范围内的异常高剂量(相当于细胞外钾离子的浓度),这在人类中是不可能实现的。
BAY 11-7082也被认为是一种能够抑制NF-kB信号级联的药物。它能够以不可逆的方式防止IKK-α的磷酸化,从而下调NF-kB的活性。[86] 已经表明,对诱导糖尿病斯普拉格-道利大鼠模型给药,BAY 11-7082可以通过抑制NF-kB调节的氧化应激来恢复大鼠的肾功能。[87]
截至2015年,在日本和中国上市的治疗类风湿性关节炎的药物艾拉莫德的生物学靶点尚不清楚,但其主要作用机制似乎是防止NF-κB活化。[88]
9 笔记编辑
- In other words, c-Fos repression allows ΔFosB to accumulate within nucleus accumbens medium spiny neurons more rapidly because it is selectively induced in this state.[89]
- ΔFosB has been implicated in causing both increases and decreases in dynorphin expression in different studies;[89][89] this table entry reflects only a decrease.
参考文献
- [1]
^Brasier AR (2006). "The NF-κB regulatory network". Cardiovascular Toxicology. 6 (2): 111–30. doi:10.1385/CT:6:2:111. PMID 17303919..
- [2]
^Perkins ND (January 2007). "Integrating cell-signalling pathways with NF-κB and IKK function". Nature Reviews Molecular Cell Biology. 8 (1): 49–62. doi:10.1038/nrm2083. PMID 17183360..
- [3]
^Gilmore TD (November 1999). "The Rel/NF-κB signal transduction pathway: introduction". Oncogene. 18 (49): 6842–4. doi:10.1038/sj.onc.1203237. PMID 10602459..
- [4]
^Tian B, Brasier AR (2003). "Identification of a nuclear factor κB-dependent gene network". Recent Progress in Hormone Research. 58: 95–130. doi:10.1210/rp.58.1.95. PMID 12795416..
- [5]
^Park HJ, Youn HS (March 2013). "Mercury induces the expression of cyclooxygenase-2 and inducible nitric oxide synthase". Toxicology and Industrial Health. 29 (2): 169–74. doi:10.1177/0748233711427048. PMID 22080037..
- [6]
^Sen R, Baltimore D (August 1986). "Multiple nuclear factors interact with the immunoglobulin enhancer sequences". Cell. 46 (5): 705–16. doi:10.1016/0092-8674(86)90346-6. PMID 3091258..
- [7]
^Karin M, Ben-Neriah Y (2000). "Phosphorylation meets ubiquitination: the control of NF-κB activity". Annual Review of Immunology. 18: 621–63. doi:10.1146/annurev.immunol.18.1.621. PMID 10837071..
- [8]
^Senftleben U, Cao Y, Xiao G, Greten FR, Krähn G, Bonizzi G, Chen Y, Hu Y, Fong A, Sun SC, Karin M (August 2001). "Activation by IKKα of a second, evolutionary conserved, NF-κB signaling pathway". Science. 293 (5534): 1495–9. doi:10.1126/science.1062677. PMID 11520989..
- [9]
^Plaksin D, Baeuerle PA, Eisenbach L (June 1993). "KBF1 (p50 NF-κB homodimer) acts as a repressor of H-2Kb gene expression in metastatic tumor cells". The Journal of Experimental Medicine. 177 (6): 1651–62. doi:10.1084/jem.177.6.1651. PMC 2191052. PMID 8496683..
- [10]
^Guan H, Hou S, Ricciardi RP (March 2005). "DNA binding of repressor nuclear factor-κB p50/p50 depends on phosphorylation of Ser337 by the protein kinase A catalytic subunit". The Journal of Biological Chemistry. 280 (11): 9957–62. doi:10.1074/jbc.m412180200. PMID 15642694..
- [11]
^Nabel GJ, Verma IM (November 1993). "Proposed NF-κB/IκB family nomenclature". Genes & Development. 7 (11): 2063. doi:10.1101/gad.7.11.2063. PMID 8224837..
- [12]
^Ghosh S, May MJ, Kopp EB (1998). "NF-κB and Rel proteins: evolutionarily conserved mediators of immune responses". Annual Review of Immunology. 16: 225–60. doi:10.1146/annurev.immunol.16.1.225. PMID 9597130..
- [13]
^Waterhouse RM, Kriventseva EV, Meister S, Xi Z, Alvarez KS, Bartholomay LC, Barillas-Mury C, Bian G, Blandin S, Christensen BM, Dong Y, Jiang H, Kanost MR, Koutsos AC, Levashina EA, Li J, Ligoxygakis P, Maccallum RM, Mayhew GF, Mendes A, Michel K, Osta MA, Paskewitz S, Shin SW, Vlachou D, Wang L, Wei W, Zheng L, Zou Z, Severson DW, Raikhel AS, Kafatos FC, Dimopoulos G, Zdobnov EM, Christophides GK (June 2007). "Evolutionary dynamics of immune-related genes and pathways in disease-vector mosquitoes". Science. 316 (5832): 1738–43. Bibcode:2007Sci...316.1738W. doi:10.1126/science.1139862. PMC 2042107. PMID 17588928..
- [14]
^(a) Chandel NS, Trzyna WC, McClintock DS, Schumacker PT (July 2000). "Role of oxidants in NF-κB activation and TNF-α gene transcription induced by hypoxia and endotoxin". Journal of Immunology. 165 (2): 1013–21. doi:10.4049/jimmunol.165.2.1013. PMID 10878378.; (b) Fitzgerald DC, Meade KG, McEvoy AN, Lillis L, Murphy EP, MacHugh DE, Baird AW (March 2007). "Tumour necrosis factor-α (TNF-α) increases nuclear factor κB (NFκB) activity in and interleukin-8 (IL-8) release from bovine mammary epithelial cells". Veterinary Immunology and Immunopathology. 116 (1–2): 59–68. doi:10.1016/j.vetimm.2006.12.008. PMID 17276517.; (c) Renard P, Zachary MD, Bougelet C, Mirault ME, Haegeman G, Remacle J, Raes M (January 1997). "Effects of antioxidant enzyme modulations on interleukin-1-induced nuclear factor κB activation". Biochemical Pharmacology. 53 (2): 149–60. doi:10.1016/S0006-2952(96)00645-4. PMID 9037247.; (d) Qin H, Wilson CA, Lee SJ, Zhao X, Benveniste EN (November 2005). "LPS induces CD40 gene expression through the activation of NF-κB and STAT-1α in macrophages and microglia". Blood. 106 (9): 3114–22. doi:10.1182/blood-2005-02-0759. PMC 1895321. PMID 16020513.; (e) Takemoto Y, Yoshiyama M, Takeuchi K, Omura T, Komatsu R, Izumi Y, Kim S, Yoshikawa J (November 1999). "Increased JNK, AP-1 and NF-κB DNA binding activities in isoproterenol-induced cardiac remodeling". Journal of Molecular and Cellular Cardiology. 31 (11): 2017–30. doi:10.1006/jmcc.1999.1033. PMID 10591028.; (f) Hargrave BY, Tiangco DA, Lattanzio FA, Beebe SJ (2003). "Cocaine, not morphine, causes the generation of reactive oxygen species and activation of NF-κB in transiently cotransfected heart cells". Cardiovascular Toxicology. 3 (2): 141–51. doi:10.1385/CT:3:2:141. PMID 14501032.; (g) Basu S, Rosenzweig KR, Youmell M, Price BD (June 1998). "The DNA-dependent protein kinase participates in the activation of NF κB following DNA damage". Biochemical and Biophysical Research Communications. 247 (1): 79–83. doi:10.1006/bbrc.1998.8741. PMID 9636658..
- [15]
^Baud'huin M, Lamoureux F, Duplomb L, Rédini F, Heymann D (September 2007). "RANKL, RANK, osteoprotegerin: key partners of osteoimmunology and vascular diseases". Cellular and Molecular Life Sciences. 64 (18): 2334–50. doi:10.1007/s00018-007-7104-0. PMID 17530461..
- [16]
^Gilmore TD (October 2006). "Introduction to NF-κB: players, pathways, perspectives". Oncogene. 25 (51): 6680–4. doi:10.1038/sj.onc.1209954. PMID 17072321..
- [17]
^Hayden MS, West AP, Ghosh S (October 2006). "NF-κB and the immune response". Oncogene. 25 (51): 6758–80. doi:10.1038/sj.onc.1209943. PMID 17072327..
- [18]
^Li Q, Verma IM (October 2002). "NF-κB regulation in the immune system". Nature Reviews. Immunology. 2 (10): 725–34. doi:10.1038/nri910. PMID 12360211..
- [19]
^Fujita T, Nolan GP, Liou HC, Scott ML, Baltimore D (July 1993). "The candidate proto-oncogene bcl-3 encodes a transcriptional coactivator that activates through NF-κB p50 homodimers". Genes & Development. 7 (7B): 1354–63. doi:10.1101/gad.7.7b.1354. PMID 8330739..
- [20]
^Franzoso G, Bours V, Park S, Tomita-Yamaguchi M, Kelly K, Siebenlist U (September 1992). "The candidate oncoprotein Bcl-3 is an antagonist of p50/NF-κB-mediated inhibition". Nature. 359 (6393): 339–42. doi:10.1038/359339a0. PMID 1406939..
- [21]
^Bours V, Franzoso G, Azarenko V, Park S, Kanno T, Brown K, Siebenlist U (March 1993). "The oncoprotein Bcl-3 directly transactivates through κB motifs via association with DNA-binding p50B homodimers". Cell. 72 (5): 729–39. doi:10.1016/0092-8674(93)90401-B. PMID 8453667..
- [22]
^Jacobs MD, Harrison SC (December 1998). "Structure of an IκBα/NF-κB complex". Cell. 95 (6): 749–58. doi:10.1016/S0092-8674(00)81698-0. PMID 9865693..
- [23]
^Basak S, Kim H, Kearns JD, Tergaonkar V, O'Dea E, Werner SL, Benedict CA, Ware CF, Ghosh G, Verma IM, Hoffmann A (January 2007). "A fourth IκB protein within the NF-κB signaling module". Cell. 128 (2): 369–81. doi:10.1016/j.cell.2006.12.033. PMC 1831796. PMID 17254973...
- [24]
^Dobrzanski P, Ryseck RP, Bravo R (March 1995). "Specific inhibition of RelB/p52 transcriptional activity by the C-terminal domain of p100". Oncogene. 10 (5): 1003–7. PMID 7898917..
- [25]
^Lo JC, Basak S, James ES, Quiambo RS, Kinsella MC, Alegre ML, Weih F, Franzoso G, Hoffmann A, Fu YX (February 2006). "Coordination between NF-κB family members p50 and p52 is essential for mediating LTβR signals in the development and organization of secondary lymphoid tissues". Blood. 107 (3): 1048–55. doi:10.1182/blood-2005-06-2452. PMC 1895903. PMID 16195333..
- [26]
^Deptala A, Bedner E, Gorczyca W, Darzynkiewicz Z (November 1998). "Activation of nuclear factor κB (NF-κB) assayed by laser scanning cytometry (LSC)". Cytometry. 33 (3): 376–82. doi:10.1002/(SICI)1097-0320(19981101)33:3<376::AID-CYTO13>3.0.CO;2-Q. PMC 3874872. PMID 9822350..
- [27]
^Nelson DE, Ihekwaba AE, Elliott M, Johnson JR, Gibney CA, Foreman BE, Nelson G, See V, Horton CA, Spiller DG, Edwards SW, McDowell HP, Unitt JF, Sullivan E, Grimley R, Benson N, Broomhead D, Kell DB, White MR (October 2004). "Oscillations in NF-κB signaling control the dynamics of gene expression". Science. 306 (5696): 704–8. doi:10.1126/science.1099962. PMID 15499023..
- [28]
^Hiscott J, Kwon H, Génin P (January 2001). "Hostile takeovers: viral appropriation of the NF-κB pathway". The Journal of Clinical Investigation. 107 (2): 143–51. doi:10.1172/JCI11918. PMC 199181. PMID 11160127..
- [29]
^Adkins I, Schulz S, Borgmann S, Autenrieth IB, Gröbner S (February 2008). "Differential roles of Yersinia outer protein P-mediated inhibition of nuclear factor-κB in the induction of cell death in dendritic cells and macrophages". Journal of Medical Microbiology. 57 (Pt 2): 139–44. doi:10.1099/jmm.0.47437-0. PMID 18201977..
- [30]
^Micheli L, Leonardi L, Conti F, Buanne P, Canu N, Caruso M, Tirone F (March 2005). "PC4 coactivates MyoD by relieving the histone deacetylase 4-mediated inhibition of myocyte enhancer factor 2C". Molecular and Cellular Biology. 25 (6): 2242–59. doi:10.1128/MCB.25.6.2242-2259.2005. PMC 1061592. PMID 15743821..
- [31]
^Micheli L, Leonardi L, Conti F, Maresca G, Colazingari S, Mattei E, Lira SA, Farioli-Vecchioli S, Caruso M, Tirone F (February 2011). "PC4/Tis7/IFRD1 stimulates skeletal muscle regeneration and is involved in myoblast differentiation as a regulator of MyoD and NF-κB". The Journal of Biological Chemistry. 286 (7): 5691–707. doi:10.1074/jbc.M110.162842. PMC 3037682. PMID 21127072..
- [32]
^Yeung F, Hoberg JE, Ramsey CS, Keller MD, Jones DR, Frye RA, Mayo MW (June 2004). "Modulation of NF-κB-dependent transcription and cell survival by the SIRT1 deacetylase". The EMBO Journal. 23 (12): 2369–80. doi:10.1038/sj.emboj.7600244. PMC 423286. PMID 15152190..
- [33]
^Bonizzi G, Bebien M, Otero DC, Johnson-Vroom KE, Cao Y, Vu D, Jegga AG, Aronow BJ, Ghosh G, Rickert RC, Karin M (October 2004). "Activation of IKKα target genes depends on recognition of specific κB binding sites by RelB:p52 dimers". The EMBO Journal. 23 (21): 4202–10. doi:10.1038/sj.emboj.7600391. PMC 524385. PMID 15470505..
- [34]
^Basak S, Shih VF, Hoffmann A (May 2008). "Generation and activation of multiple dimeric transcription factors within the NF-κB signaling system". Molecular and Cellular Biology. 28 (10): 3139–50. doi:10.1128/MCB.01469-07. PMC 2423155. PMID 18299388..
- [35]
^Smith EM, Gregg M, Hashemi F, Schott L, Hughes TK (2006-07-01). "Corticotropin Releasing Factor (CRF) activation of NF-κB-directed transcription in leukocytes". Cellular and Molecular Neurobiology. 26 (4–6): 1021–36. doi:10.1007/s10571-006-9040-1. PMID 16633893..
- [36]
^Livolsi A, Busuttil V, Imbert V, Abraham RT, Peyron JF (March 2001). "Tyrosine phosphorylation-dependent activation of NF-κB. Requirement for p56 LCK and ZAP-70 protein tyrosine kinases". European Journal of Biochemistry. 268 (5): 1508–15. doi:10.1046/j.1432-1327.2001.02028.x. PMID 11231305..
- [37]
^Meffert MK, Chang JM, Wiltgen BJ, Fanselow MS, Baltimore D (October 2003). "NF-κB functions in synaptic signaling and behavior". Nature Neuroscience. 6 (10): 1072–8. doi:10.1038/nn1110. PMID 12947408..
- [38]
^Albensi BC, Mattson MP (February 2000). "Evidence for the involvement of TNF and NF-κB in hippocampal synaptic plasticity". Synapse. 35 (2): 151–9. doi:10.1002/(SICI)1098-2396(200002)35:2<151::AID-SYN8>3.0.CO;2-P. PMID 10611641..
- [39]
^Wang J, Fu XQ, Lei WL, Wang T, Sheng AL, Luo ZG (August 2010). "Nuclear factor κB controls acetylcholine receptor clustering at the neuromuscular junction". The Journal of Neuroscience. 30 (33): 11104–13. doi:10.1523/JNEUROSCI.2118-10.2010. PMID 20720118..
- [40]
^Boersma MC, Dresselhaus EC, De Biase LM, Mihalas AB, Bergles DE, Meffert MK (April 2011). "A requirement for nuclear factor-κB in developmental and plasticity-associated synaptogenesis". The Journal of Neuroscience. 31 (14): 5414–25. doi:10.1523/JNEUROSCI.2456-10.2011. PMC 3113725. PMID 21471377..
- [41]
^Gutierrez H, Hale VA, Dolcet X, Davies A (April 2005). "NF-κB signalling regulates the growth of neural processes in the developing PNS and CNS". Development. 132 (7): 1713–26. doi:10.1242/dev.01702. PMID 15743881..
- [42]
^Zaheer A, Yorek MA, Lim R (December 2001). "Effects of glia maturation factor overexpression in primary astrocytes on MAP kinase activation, transcription factor activation, and neurotrophin secretion". Neurochemical Research. 26 (12): 1293–9. doi:10.1023/A:1014241300179. PMID 11885780..
- [43]
^Qiu J, Hu X, Nesic O, Grafe MR, Rassin DK, Wood TG, Perez-Polo JR (July 2004). "Effects of NF-κB oligonucleotide "decoys" on gene expression in P7 rat hippocampus after hypoxia/ischemia". Journal of Neuroscience Research. 77 (1): 108–18. doi:10.1002/jnr.20156. PMID 15197744..
- [44]
^Listwak SJ, Rathore P, Herkenham M (October 2013). "Minimal NF-κB activity in neurons". Neuroscience. 250: 282–99. doi:10.1016/j.neuroscience.2013.07.013. PMC 3785079. PMID 23872390..
- [45]
^Jarosinski KW, Whitney LW, Massa PT (September 2001). "Specific deficiency in nuclear factor-κB activation in neurons of the central nervous system". Laboratory Investigation; A Journal of Technical Methods and Pathology. 81 (9): 1275–88. doi:10.1038/labinvest.3780341. PMID 11555675..
- [46]
^Herkenham M, Rathore P, Brown P, Listwak SJ (October 2011). "Cautionary notes on the use of NF-κB p65 and p50 antibodies for CNS studies". Journal of Neuroinflammation. 8: 141. doi:10.1186/1742-2094-8-141. PMC 3210105. PMID 21999414..
- [47]
^Moerman AM, Mao X, Lucas MM, Barger SW (April 1999). "Characterization of a neuronal κB-binding factor distinct from NF-κB". Brain Research. Molecular Brain Research. 67 (2): 303–15. doi:10.1016/s0169-328x(99)00091-1. PMID 10216229..
- [48]
^Mao XR, Moerman-Herzog AM, Chen Y, Barger SW (May 2009). "Unique aspects of transcriptional regulation in neurons--nuances in NFκB and Sp1-related factors". Journal of Neuroinflammation. 6: 16. doi:10.1186/1742-2094-6-16. PMC 2693111. PMID 19450264..
- [49]
^Mao X, Yang SH, Simpkins JW, Barger SW (March 2007). "Glutamate receptor activation evokes calpain-mediated degradation of Sp3 and Sp4, the prominent Sp-family transcription factors in neurons". Journal of Neurochemistry. 100 (5): 1300–14. doi:10.1111/j.1471-4159.2006.04297.x. PMC 1949346. PMID 17316402..
- [50]
^Vlahopoulos, SA (August 2017). "Aberrant control of NF-κB in cancer permits transcriptional and phenotypic plasticity, to curtail dependence on host tissue: molecular mode". Cancer Biology & Medicine. 14 (3): 254–270. doi:10.20892/j.issn.2095-3941.2017.0029. PMC 5570602. PMID 28884042..
- [51]
^Vlahopoulos SA, Cen O, Hengen N, Agan J, Moschovi M, Critselis E, Adamaki M, Bacopoulou F, Copland JA, Boldogh I, Karin M, Chrousos GP (August 2015). "Dynamic aberrant NF-κB spurs tumorigenesis: a new model encompassing the microenvironment". Cytokine & Growth Factor Reviews. 26 (4): 389–403. doi:10.1016/j.cytogfr.2015.06.001. PMC 4526340. PMID 26119834..
- [52]
^Sheikh MS, Huang Y (2003). "Death receptor activation complexes: it takes two to activate TNF receptor 1". Cell Cycle. 2 (6): 550–2. doi:10.4161/cc.2.6.566. PMID 14504472..
- [53]
^Li YY, Chung GT, Lui VW, To KF, Ma BB, Chow C, et al. (January 2017). "Exome and genome sequencing of nasopharynx cancer identifies NF-κB pathway activating mutations". Nature Communications. 8: 14121. Bibcode:2017NatCo...814121L. doi:10.1038/ncomms14121. PMC 5253631. PMID 28098136..
- [54]
^Escárcega RO, Fuentes-Alexandro S, García-Carrasco M, Gatica A, Zamora A (March 2007). "The transcription factor nuclear factor-κB and cancer". Clinical Oncology. 19 (2): 154–61. doi:10.1016/j.clon.2006.11.013. PMID 17355113..
- [55]
^Liu F, Bardhan K, Yang D, Thangaraju M, Ganapathy V, Waller JL, Liles GB, Lee JR, Liu K (July 2012). "NF-κB directly regulates Fas transcription to modulate Fas-mediated apoptosis and tumor suppression". The Journal of Biological Chemistry. 287 (30): 25530–40. doi:10.1074/jbc.M112.356279. PMC 3408167. PMID 22669972..
- [56]
^Monaco C, Andreakos E, Kiriakidis S, Mauri C, Bicknell C, Foxwell B, Cheshire N, Paleolog E, Feldmann M (April 2004). "Canonical pathway of nuclear factor κB activation selectively regulates proinflammatory and prothrombotic responses in human atherosclerosis". Proceedings of the National Academy of Sciences of the United States of America. 101 (15): 5634–9. doi:10.1073/pnas.0401060101. PMC 397455. PMID 15064395..
- [57]
^Venuraju SM, Yerramasu A, Corder R, Lahiri A (May 2010). "Osteoprotegerin as a predictor of coronary artery disease and cardiovascular mortality and morbidity". Journal of the American College of Cardiology. 55 (19): 2049–61. doi:10.1016/j.jacc.2010.03.013. PMID 20447527..
- [58]
^Lieb W, Gona P, Larson MG, Massaro JM, Lipinska I, Keaney JF, Rong J, Corey D, Hoffmann U, Fox CS, Vasan RS, Benjamin EJ, O'Donnell CJ, Kathiresan S (September 2010). "Biomarkers of the osteoprotegerin pathway: clinical correlates, subclinical disease, incident cardiovascular disease, and mortality". Arteriosclerosis, Thrombosis, and Vascular Biology. 30 (9): 1849–54. doi:10.1161/ATVBAHA.109.199661. PMC 3039214. PMID 20448212..
- [59]
^Song XQ, Lv LX, Li WQ, Hao YH, Zhao JP (March 2009). "The interaction of nuclear factor-κB and cytokines is associated with schizophrenia". Biological Psychiatry. 65 (6): 481–8. doi:10.1016/j.biopsych.2008.10.018. PMID 19058794..
- [60]
^Kaisari S, Rom O, Aizenbud D, Reznick AZ (2013). "Involvement of NF-κB and muscle specific E3 ubiquitin ligase MuRF1 in cigarette smoke-induced catabolism in C2 myotubes". Advances in Experimental Medicine and Biology. 788: 7–17. doi:10.1007/978-94-007-6627-3_2. ISBN 978-94-007-6626-6. PMID 23835952..
- [61]
^Hajishengallis G, Chavakis T (January 2013). "Endogenous modulators of inflammatory cell recruitment". Trends in Immunology. 34 (1): 1–6. doi:10.1016/j.it.2012.08.003. PMC 3703146. PMID 22951309..
- [62]
^Vidal PM, Lemmens E, Dooley D, Hendrix S (February 2013). "The role of "anti-inflammatory" cytokines in axon regeneration". Cytokine & Growth Factor Reviews. 24 (1): 1–12. doi:10.1016/j.cytogfr.2012.08.008. PMID 22985997..
- [63]
^Grivennikov SI, Karin M (February 2010). "Dangerous liaisons: STAT3 and NF-κB collaboration and crosstalk in cancer". Cytokine & Growth Factor Reviews. 21 (1): 11–9. doi:10.1016/j.cytogfr.2009.11.005. PMC 2834864. PMID 20018552..
- [64]
^Bonavita E, Galdiero MR, Jaillon S, Mantovani A (2015). "Phagocytes as Corrupted Policemen in Cancer-Related Inflammation". Advances in Cancer Research. 128: 141–71. doi:10.1016/bs.acr.2015.04.013. ISBN 9780128023167. PMID 26216632..
- [65]
^Sionov RV, Fridlender ZG, Granot Z (December 2015). "The Multifaceted Roles Neutrophils Play in the Tumor Microenvironment". Cancer Microenvironment. 8 (3): 125–58. doi:10.1007/s12307-014-0147-5. PMC 4714999. PMID 24895166..
- [66]
^Kong X, Li L, Li Z, Xie K (December 2012). "Targeted destruction of the orchestration of the pancreatic stroma and tumor cells in pancreatic cancer cases: molecular basis for therapeutic implications". Cytokine & Growth Factor Reviews. 23 (6): 343–56. doi:10.1016/j.cytogfr.2012.06.006. PMC 3505269. PMID 22749856..
- [67]
^Mecollari V, Nieuwenhuis B, Verhaagen J (2014). "A perspective on the role of class III semaphorin signaling in central nervous system trauma". Frontiers in Cellular Neuroscience. 8: 328. doi:10.3389/fncel.2014.00328. PMC 4209881. PMID 25386118..
- [68]
^NEMO deficiency syndrome information, Great Ormond Street Hospital for Children.
- [69]
^Robison AJ, Nestler EJ (October 2011). "Transcriptional and epigenetic mechanisms of addiction". Nature Reviews. Neuroscience. 12 (11): 623–37. doi:10.1038/nrn3111. PMC 3272277. PMID 21989194..
- [70]
^US6,410,516 (PDF 版本) (于2002年06月25日注册) Baltimore D; Sen R; Sharp PA; Singh H; Staudt L; Lebowitz JH; Baldwin Jr AS; Clerc RG; Corcoran LM; Baeuerle PA; Lenardo MJ; Fan C-M; Maniatis TPD——Nuclear factors associated with transcriptional regulation。.
- [71]
^Karin M (March 2008). "The IκB kinase - a bridge between inflammation and cancer". Cell Research. 18 (3): 334–42. doi:10.1038/cr.2008.30. PMID 18301380..
- [72]
^Pikarsky E, Ben-Neriah Y (April 2006). "NF-κB inhibition: a double-edged sword in cancer?". European Journal of Cancer. 42 (6): 779–84. doi:10.1016/j.ejca.2006.01.011. PMID 16530406..
- [73]
^Mantovani A, Marchesi F, Portal C, Allavena P, Sica A (2008). "Linking inflammation reactions to cancer: novel targets for therapeutic strategies". Advances in Experimental Medicine and Biology. 610: 112–27. doi:10.1007/978-0-387-73898-7_9. ISBN 978-0-387-73897-0. PMID 18593019..
- [74]
^Paur I, Balstad TR, Kolberg M, Pedersen MK, Austenaa LM, Jacobs DR, Blomhoff R (May 2010). "Extract of oregano, coffee, thyme, clove, and walnuts inhibits NF-κB in monocytes and in transgenic reporter mice". Cancer Prevention Research. 3 (5): 653–63. doi:10.1158/1940-6207.CAPR-09-0089. PMID 20424131..
- [75]
^Ding Y, Huang X, Liu T, Fu Y, Tan Z, Zheng H, Zhou T, Dai J, Xu W (October 2012). "The Plasmodium circumsporozoite protein, a novel NF-κB inhibitor, suppresses the growth of SW480". Pathology Oncology Research. 18 (4): 895–902. doi:10.1007/s12253-012-9519-7. PMID 22678765..
- [76]
^Garg A, Aggarwal BB (June 2002). "Nuclear transcription factor-κB as a target for cancer drug development". Leukemia. 16 (6): 1053–68. doi:10.1038/sj.leu.2402482. PMID 12040437..
- [77]
^Sethi G, Sung B, Aggarwal BB (January 2008). "Nuclear factor-κB activation: from bench to bedside". Experimental Biology and Medicine. 233 (1): 21–31. doi:10.3181/0707-MR-196. PMID 18156302..
- [78]
^Vlahopoulos S, Boldogh I, Casola A, Brasier AR (September 1999). "Nuclear factor-κB-dependent induction of interleukin-8 gene expression by tumor necrosis factor alpha: evidence for an antioxidant sensitive activating pathway distinct from nuclear translocation". Blood. 94 (6): 1878–89. PMID 10477716..
- [79]
^Hamdy NA (January 2008). "Denosumab: RANKL inhibition in the management of bone loss". Drugs of Today. 44 (1): 7–21. doi:10.1358/dot.2008.44.1.1178467. PMID 18301800..
- [80]
^Cvek B, Dvorak Z (2007). "Targeting of nuclear factor-κB and proteasome by dithiocarbamate complexes with metals". Current Pharmaceutical Design. 13 (30): 3155–67. doi:10.2174/138161207782110390. PMID 17979756..
- [81]
^Blakely CM, Pazarentzos E, Olivas V, Asthana S, Yan JJ, Tan I, Hrustanovic G, Chan E, Lin L, Neel DS, Newton W, Bobb KL, Fouts TR, Meshulam J, Gubens MA, Jablons DM, Johnson JR, Bandyopadhyay S, Krogan NJ, Bivona TG (April 2015). "NF-κB-activating complex engaged in response to EGFR oncogene inhibition drives tumor cell survival and residual disease in lung cancer". Cell Reports. 11 (1): 98–110. doi:10.1016/j.celrep.2015.03.012. PMC 4394036. PMID 25843712..
- [82]
^Fabre C, Mimura N, Bobb K, Kong SY, Gorgun G, Cirstea D, Hu Y, Minami J, Ohguchi H, Zhang J, Meshulam J, Carrasco RD, Tai YT, Richardson PG, Hideshima T, Anderson KC (September 2012). "Dual inhibition of canonical and noncanonical NF-κB pathways demonstrates significant antitumor activities in multiple myeloma". Clinical Cancer Research. 18 (17): 4669–81. doi:10.1158/1078-0432.CCR-12-0779. PMC 4456190. PMID 22806876..
- [83]
^Shono Y, Tuckett AZ, Liou HC, Doubrovina E, Derenzini E, Ouk S, Tsai JJ, Smith OM, Levy ER, Kreines FM, Ziegler CG, Scallion MI, Doubrovin M, Heller G, Younes A, O'Reilly RJ, van den Brink MR, Zakrzewski JL (January 2016). "Characterization of a c-Rel Inhibitor That Mediates Anticancer Properties in Hematologic Malignancies by Blocking NF-κB-Controlled Oxidative Stress Responses". Cancer Research. 76 (2): 377–89. doi:10.1158/0008-5472.CAN-14-2814. PMC 4715937. PMID 26744524..
- [84]
^Yamamoto M, Horie R, Takeiri M, Kozawa I, Umezawa K (September 2008). "Inactivation of NF-κB components by covalent binding of (-)-dehydroxymethylepoxyquinomicin to specific cysteine residues". Journal of Medicinal Chemistry. 51 (18): 5780–8. doi:10.1021/jm8006245. PMID 18729348..
- [85]
^"Role of RCP006 as an anti-inflammatory agent". Roskamp Institute. Retrieved 2011-09-06..
- [86]
^Kolati SR, Kasala ER, Bodduluru LN, Mahareddy JR, Uppulapu SK, Gogoi R, Barua CC, Lahkar M (March 2015). "BAY 11-7082 ameliorates diabetic nephropathy by attenuating hyperglycemia-mediated oxidative stress and renal inflammation via NF-κB pathway". Environmental Toxicology and Pharmacology. 39 (2): 690–9. doi:10.1016/j.etap.2015.01.019. PMID 25704036..
- [87]
^Kumar A, Negi G, Sharma SS (May 2012). "Suppression of NF-κB and NF-κB regulated oxidative stress and neuroinflammation by BAY 11-7082 (IκB phosphorylation inhibitor) in experimental diabetic neuropathy". Biochimie. 94 (5): 1158–65. doi:10.1016/j.biochi.2012.01.023. PMID 22342224..
- [88]
^Tanaka K, Yamaguchi T, Hara M (May 2015). "Iguratimod for the treatment of rheumatoid arthritis in Japan". Expert Review of Clinical Immunology. 11 (5): 565–73. doi:10.1586/1744666X.2015.1027151. PMID 25797025..
- [89]
^Ruffle JK (November 2014). "Molecular neurobiology of addiction: what's all the (Δ)FosB about?". The American Journal of Drug and Alcohol Abuse. 40 (6): 428–37. doi:10.3109/00952990.2014.933840. PMID 25083822..
暂无