反键轨道
编辑1 双原子分子编辑
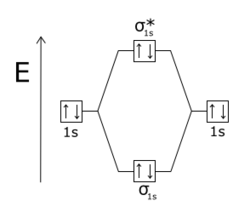
反键分子轨道(MOs)的能量通常高于成键轨道。当原子结合成分子时,形成成键和反键轨道。如果两个氢原子最初相距很远,它们有相同的原子轨道。然而,随着两个原子之间的间距变小,电子的波函数开始重叠。泡利不相容原理禁止一个分子中的任何两个电子(e-)具有相同的一组量子数。因此,孤立原子的每个原始原子轨道(例如基态能级1s)分裂成属于该对原子的两个分子轨道,一个能量低于原始能级,一个能量高于原始能级。能量低于独立原子轨道的轨道是成键轨道,成键轨道更稳定,促进两个氢原子成键形成H2。较高能量的轨道是反键轨道,它不太稳定,如果被占据,则不利于成键。在像H2这样的分子中,两个电子通常占据低能成键轨道,因此氢分子比单独的氢原子更稳定。
当两个原子核之间的电子密度小,无法产生键相互作用时,分子轨道就会成为反键轨道。当一个分子轨道在两个原子之间的波节面上改变符号(从正到负)时,被认为是相对于那些原子反键合的。反键轨道在分子轨道图上通常标有星号(*)。
在同核双原子分子中,σ*(σ星)反键轨道像σ键一样,没有穿过两个原子核的波节面,π*(π星)轨道同π键相似,有一个穿过两个原子核的波节面。泡利不相容原理规定相互作用系统中没有两个电子可以具有相同的量子态。如果成键轨道被填满,那么任何额外的电子将占据反键轨道。这发生在He2分子中,其中1σ和1σ*轨道都被填充。由于反键轨道比成键轨道更利于反键合,He2分子比两个单独的氦原子具有更高的能量,因此它是不稳定的。
2 多原子分子编辑
在有多个原子的分子中,一些轨道可能在两个以上的原子上离域。特定的分子轨道可以与一些相邻的原子对键合,与其他原子对反键合。如果键合的相互作用超过反键合的相互作用,则分子轨道被称为成键轨道,而如果反键合的相互作用超过成键的相互作用,分子轨道被称为反键轨道。
例如,丁二烯的π轨道在所有四个碳原子上都是离域的。成键的π键在基态被占据:π1键在所有碳之间键合,π2键在C1和C2之间以及C3和C4之间键合,并且在C2和C3之间反键合。也有反键π轨道,如图所示,有两个和三个反键相互作用;它们在基态是空的,但是在激发态可能被占据。
类似地,六个碳原子的苯有三个成键π轨道和三个反键π轨道。因为每个碳原子给苯的π体系贡献一个电子,所以有六个π电子填充了三个能量最低的π分子轨道(成键π轨道)。
反键轨道对于用分子轨道理论解释化学反应也很重要。1981年,因为罗阿尔德·霍夫曼和福井健一的工作和对化学反应的定性分子轨道解释的进一步发展,他们共同获得了1981年诺贝尔化学奖。
参考文献
暂无