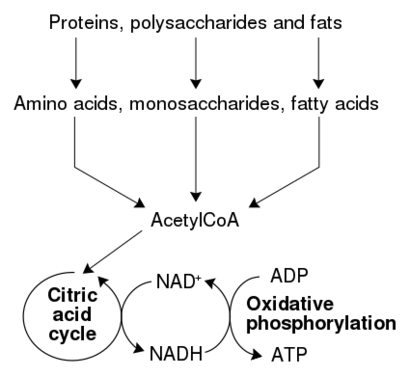
代谢
编辑新陈代谢,是在有机体中一组维持生命的化学反应。代谢的三个主要目的是:将食物转化为能量,以进行细胞过程;将食物/燃料转化为蛋白质、脂质、核酸和一些碳水化合物的构件;和消除含氮废物。这些酶催化的反应允许生物体生长和繁殖,保持它们的结构,并对环境做出反应。(代谢这个词也可以指生物体中发生的所有化学反应的总和,包括消化和物质进入不同细胞,以及在不同细胞之间的运输,在这种情况下,细胞内的上述一组反应被称为中间代谢)。
代谢反应可以分为分解代谢-分解化合物(例如,细胞呼吸将葡萄糖分解为丙酮酸盐);或者合成代谢-建造(合成)化合物(如蛋白质、碳水化合物、脂质和核酸)。通常,分解代谢释放能量,合成代谢消耗能量。
代谢的化学反应组成代谢途径,其中一种化学物质通过一系列步骤转化成另一种化学物质,每个步骤都由特定的酶促进。酶对代谢至关重要,因为它们通过将它们与释放能量的自发反应耦合,允许生物体驱动需要能量但自身不会发生的理想反应。酶充当催化剂 -它们允许反应更快地进行-并且它们还允许代谢反应速率的调节,例如响应于细胞的环境变化或来自其他细胞的信号。
特定生物体的代谢系统决定了它能发现哪些物质有营养,哪些物质有毒。例如,一些原核生物使用硫化氢作为一种营养物质,这种气体对动物有毒。生物体的基础代谢率是所有这些化学反应消耗能量的量度。
代谢的一个重要特征是存在于明显不同物种之间基本代谢途径的相似性。[1]例如,作为柠檬酸循环中的中间体的一组羧酸存在于所有已知的生物体中,存在于多种物种中,如单细胞细菌大肠杆菌以及巨大的多细胞生物例如大象。代谢途径中的这些相似性可能是由于它们出现于进化史的早期,并因其功效而被保留下来。
目录编辑
1 关键生化物质编辑
组成动物、植物和微生物的大多数结构由三类基本的分子组成:氨基酸,碳水化合物和脂质(通常称为脂肪)。由于这些分子对生命至关重要,代谢反应要么侧重于在细胞和组织构建过程中制造这些分子,要么通过消化将其分解并用作能量来源。这些生物化学物质可以结合在一起形成聚合物,例如脱氧核糖核酸和蛋白质,它们是生命中必不可少的大分子。
| 分子类型 | 单体形式 名称 |
聚合物形式 名称 |
聚合物形式 例子 |
|---|---|---|---|
| 氨基酸 | 氨基酸 | 蛋白质(由多肽组成) | 纤维蛋白质和球状蛋白 |
| 碳水化合物 | 单糖 | 多糖 | 淀粉、糖原和纤维素 |
| 核酸 | 核苷酸 | 多核苷酸 | 脱氧核糖核酸和核糖核酸 |
1.1 氨基酸和蛋白质
蛋白质由氨基酸组成并通过肽键连接在一起的线性链。许多蛋白质是酶,催化代谢中的化学反应。其它蛋白质具有结构功能或机械功能,例如形成细胞骨架的蛋白质,细胞骨架是维持细胞形状的支架系统。[2]蛋白质在细胞信号传导、免疫反应、细胞粘附、主动转运跨膜和细胞周期中也很重要。氨基酸还通过为进入柠檬酸循环(三羧酸循环)提供碳源来促进细胞能量代谢,[3]尤其是当主要能量来源如葡萄糖缺乏时,或者当细胞经受代谢压力时。[4]
1.2 脂质
脂质是最多样化的一组生化物质。它们的主要结构用途是作为生物膜内部和外部的一部分,例如细胞膜,或者作为一种能源。脂质通常被定义为疏水性或两亲性生物分子,但会溶解在有机溶剂中,例如苯或氯仿。[5]脂肪是一大组含有脂肪酸和甘油的化合物;连接到三个脂肪酸酯上甘油分子被称为三酰基甘油酯。[6]这种基本结构存在几种变体,包括交替的骨架如神经鞘脂类中的鞘氨醇,和亲水性的基团如磷酸盐,如磷脂。类固醇如胆固醇是另一类主要脂质。[7]
1.3 碳水化合物
碳水化合物是醛或酮,带有许多羟基,可以直链或环的形式存在。碳水化合物是最丰富的生物分子,具有多种作用,如储存和运输能量 ( 淀粉,糖原)和结构成分(植物中的纤维素,动物中的甲壳素)。基本碳水化合物单位被称为单糖,包括半乳糖、果糖,最重要的是葡萄糖。单糖能以近乎无限的方式连接在一起组成多糖。[8]
1.4 核苷酸
两个核酸,即脱氧核糖核酸和核糖核酸,是核苷酸的聚合物。每个核苷酸由连接到核糖或脱氧核糖糖基团的磷酸盐组成,该糖基团连接到含氮碱基。核酸对于遗传信息的存储和使用至关重要,并通过转录和蛋白质生物合成过程对其进行解释。这些信息受脱氧核糖核酸修复机制的保护,并通过脱氧核糖核酸复制进行传播。许多病毒具有 RNA基因组,例如HIV ,它使用逆转录从其病毒RNA基因组中创建DNA模板。[9]核酶如剪接体和核糖体中的核糖核酸与酶相似,因为它可以催化化学反应。单个的核苷是通过将核碱基连接到核糖上制成的。这些碱基是含氮的杂环,分类为嘌呤或嘧啶。核苷酸也在代谢基团转移反应中充当辅酶。[10]
1.5 辅酶
代谢涉及大量的化学反应,但大多数属于一些基本类型的反应,这些反应涉及原子的官能团及其分子内的键的转移。[11]这种常见的化学反应允许细胞使用一小组代谢中间体在不同反应之间携带化学基团。[10]这些基团转移中间体被称为辅酶。每类基团转移反应由一种特定的辅酶进行,辅酶是产生它的一组酶和消耗它的一组酶的底物。因此,这些辅酶不断被制造、消耗和回收。
一种核心辅酶是三磷酸腺苷(ATP),细胞的通用能量货币。这种核苷酸用于在不同的化学反应之间传递化学能。细胞中只有少量的三磷酸腺苷,但是随着它的不断再生,人体每天可以使用大约自身重量的三磷酸腺苷。三磷酸腺苷作为分解代谢和合成代谢之间的桥梁。分解代谢分解分子,合成代谢将它们结合在一起。分解代谢反应产生三磷酸腺苷,合成代谢反应消耗它。它还在磷酸化反应中充当磷酸基团的载体。
维生素是细胞中不能制造,并有少量需求的有机化合物。在人类营养学中,大多数维生素在修饰后起辅酶的作用;例如,所有水溶性维生素在细胞中使用时都被磷酸化或偶联到核苷酸上。[12] 烟酰胺腺嘌呤二核苷酸 (NAD+),维生素B的衍生物3(烟酸),是一种重要的辅酶,充当氢受体。数百种不同类型的脱氢酶从它们的底物上除去电子并还原 NAD+进入NADH。辅酶的这种还原形式是细胞中任何需要还原底物的还原酶的底物。[13]烟酰胺腺嘌呤二核苷酸在细胞中以两种相关的形式存在,NADH和NADPH。NAD+/NADH形式在分解代谢反应中更重要,而NADP+/NADPH用于合成代谢反应。
1.6 矿物质和辅因子
无机元素在新陈代谢中起着关键作用,有些是高浓度下起作用(例如钠和钾),而另一些在微小浓度下起作用。哺乳动物大约99%的质量是由碳、氮、钙、钠、氯、钾、氢、磷、氧这些元素和硫组成的。[14] 有机化合物(蛋白质、脂类和碳水化合物)含有大部分的碳和氮,大多数氧和氢以水的形式存在。[14]
丰富的无机元素充当离子电解质,最重要的离子是钠、钾、钙、镁、氯化物、磷酸盐和有机离子碳酸氢盐。在细胞膜上保持精确的离子梯度可保持渗透压和酸碱度。[15]离子对于神经和肌肉功能也很关键,因为这些组织中的动作电位是通过胞外液和细胞液胞质液之间的电解质交换产生的。[16]电解质通过细胞膜上被称为离子通道的蛋白质进入和离开细胞。例如,肌肉收缩取决于钙、钠和钾通过细胞膜上离子通道和 T小管的运动[17]
过渡金属通常作为微量元素存在于生物体中,其中锌和铁最为丰富。[18][19]这些金属在一些蛋白质中用作辅因子,对于酶的活性如过氧化氢酶和氧载体蛋白如血红蛋白是必不可少的。[20]金属辅因子与蛋白质中的特定位点紧密结合;虽然辅酶因子在催化过程中可以被修饰,但它们总是在催化反应结束时恢复到原来的状态。金属微量营养素被特定转运体吸收到生物体中,并在不使用时与储存蛋白如铁蛋白或金属硫蛋白结合。[21][22]
2 分解代谢编辑
分解代谢是分解大分子的一系列代谢过程。这些包括分解和氧化食物分子。分解代谢反应的目的是提供构建分子的合成代谢反应所需的能量和组分。这些分解代谢反应的确切性质因生物体而异,生物体可以根据它们的能量和碳源(它们的主要营养组)进行分类,如下表所示。有机分子被有机营养物用作能量来源,而无机营养生物使用无机底物,光营养物捕获阳光作为化学能。然而,所有这些不同形式的代谢都依赖于氧化还原反应,该反应涉及电子从还原供体分子如有机分子、水、氨、硫化氢或亚铁离子转移到受体分子如氧、硝酸盐或硫酸盐[23]在动物中,这些反应涉及复杂有机分子被分解成更简单的分子,例如二氧化碳和水。在光合的生物体,如植物和蓝细菌,这些电子转移反应不释放能量,而是用作储存从太阳光吸收的能量的一种方式。
| 能源 | 阳光 | 光子- | -营养 | ||
| 预制分子 | 化学- | ||||
| 电子供体 | 有机化合物 | 有机- | |||
| 无机化合物 | 岩性- | ||||
| 碳源 | 有机化合物 | 不同- | |||
| 无机化合物 | 相同- | ||||
动物中最常见的一组分解代谢反应可以分为三个主要阶段。在第一阶段,大的有机分子,例如蛋白质、多糖或脂质,被消化成它们在细胞外的较小组分。接下来,这些较小的分子被细胞吸收并转化为更小的分子,通常是释放一些能量的乙酰辅酶A。最后,辅酶A上的乙酰基在柠檬酸循环和电子传递链中被氧化成水和二氧化碳,释放出通过还原辅酶烟酰胺腺嘌呤二核苷酸 (NAD+)储存的能量并转化为NADH。
2.1 消化
淀粉、纤维素或蛋白质等大分子不能被细胞迅速吸收,必须先被分解成更小的单元,然后才能用于细胞代谢。这些聚合物由几种常见的酶进行消化。这些消化酶包括将蛋白质消化成氨基酸的蛋白酶,以及将多糖消化成单糖的糖苷水解酶。
微生物只是将消化酶分泌到周围环境中,[24][25]而动物仅从其肠道,包括胃、胰腺和唾液腺中的专门细胞分泌这些酶[26]这些胞外酶释放的氨基酸或糖随后被主动转运蛋白泵入细胞。[27][28]
2.2 有机化合物供能
碳水化合物分解代谢是将碳水化合物分解成更小的单位。碳水化合物通常被消化成单糖而进入细胞。[29]一旦进入细胞,主要的分解途径是糖酵解,其中糖如葡萄糖和果糖被转化为丙酮酸,并产生一些三磷酸腺苷。丙酮酸盐是几种代谢途径中的中间体,但大多数通过有氧(含氧)糖酵解转化为乙酰辅酶A ,并进入柠檬酸循环。虽然柠檬酸循环中会产生更多的三磷酸腺苷,但最重要的产物是NADH,它是由NAD+制成的。当乙酰辅酶A被氧化时,这种氧化释放出作为废物的二氧化碳。在无氧条件下,糖酵解通过酶乳酸脱氢酶将NADH重新氧化为NAD+以在糖酵解中重新使用来产生乳酸。葡萄糖分解的另一种途径是戊糖磷酸途径,它减少辅酶NADPH ,产生戊糖,如核糖,核酸的糖组分。
脂肪通过水解分解为游离脂肪酸和甘油。甘油进入糖酵解,脂肪酸被β氧化分解,释放乙酰辅酶A,然后将其输入柠檬酸循环。脂肪酸在氧化时比碳水化合物释放更多的能量,因为碳水化合物在其结构中含有更多的氧。类固醇也在类似于β氧化的过程中被一些细菌分解,这个分解过程涉及大量乙酰辅酶A、丙酰辅酶A和丙酮酸盐的释放,这些都可以被细胞用作能量。结核杆菌也可以在作为唯一碳源的脂质胆固醇上生长,并且胆固醇使用途径中涉及的基因,已被证实在结核杆菌感染的生命周期的不同阶段是重要的。[30]
氨基酸或者用于合成蛋白质和其他生物分子,或者被氧化成尿素和二氧化碳以作为能源。[31]氧化途径始于用转氨酶去除氨基。氨基被送入尿素循环,留下酮酸形式的去氨基碳骨架。这些酮酸中的一些是柠檬酸循环中的中间体,例如谷氨酸的脱氨反应形成α- 酮戊二酸。[32]生糖氨基酸还可以通过糖异生作用转化为葡萄糖(如下所述)。[33]
3 能量转换编辑
3.1 氧化磷酸化
在氧化磷酸化中,从蛋白质酸循环等活动的有机分子中移除的电子被转移到氧中,释放的能量用于制备三磷酸腺苷(ATP)。这在真核生物中是通过线粒体膜中一系列被称为电子传递链的蛋白质来完成的。在原核生物中,这些蛋白质存在于细胞的内膜中。[34]这些蛋白质利用从还原的分子如NADH传递电子到氧上释放的能量来泵送质子穿过膜。[35]
将质子从线粒体中泵出会产生穿过膜的质子浓度差,并产生电化学梯度。[36]这种力量通过一种叫做 ATP合成酶的酶将质子驱回线粒体。质子的流动使茎杆亚基扭转,导致合酶结构域的活性位点改变形状并磷酸化二磷酸腺苷 -将其转化为三磷酸腺苷。[37]
3.2 来自无机化合物的能量
化能无机营养是一种在原核生物中发现的代谢类型,其能量是从无机化合物的氧化获得的。这些生物可以使用氢,[37]还原硫化合物(如硫化物、硫化氢和硫代硫酸盐),[38] 亚铁(FeI)[38]或者氨水[39]作为还原能量的来源,它们从这些化合物与电子受体如氧或亚硝酸的氧化中获得能量。[40]这些微生物过程对于全球生物地球化学循环很重要,如乙酰化、硝化和反硝化,对土壤肥力至关重要。[41][42]
3.3 光能
阳光中的能量被植物、蓝细菌、紫色细菌、绿色硫细菌和一些原生生物捕获。这一过程通常与二氧化碳转化为有机化合物有关,作为光合作用的一部分,这将在下文讨论。然而,能量捕获和碳固定系统可以在原核生物中单独操作,因为紫色细菌和绿色硫细菌可以使用阳光作为能源,同时在碳固定和有机化合物发酵之间切换。[43][44]
在许多生物体中,太阳能的捕获原则上类似于氧化磷酸化,因为它涉及到以质子浓度梯度存储能量。然后这个质子动力势驱动三磷酸腺苷的合成。[37]驱动这个电子传递链所需的电子来自叫做光合反应中心或视紫红质。反应中心根据光合色素类型分为两类,大多数光合细菌只有一种类型,而植物和蓝藻有两种。[45]
在植物、藻类和蓝细菌中,光系统II 使用光能从水中移除电子,释放氧气作为废物。然后电子流向细胞色素b6f复合物,该复合物利用它们的能量将质子泵过叶绿体中的类囊体膜。[46]这些质子像以前一样,在驱动ATP合成酶时穿过细胞膜返回。然后,电子流过光系统I ,可以用来还原辅酶NADP+,用于下文讨论的卡尔文循环,或回收用于进一步生成三磷酸腺苷。[46]
4 同化作用编辑
同化作用是一组建设性代谢过程,其中分解代谢释放的能量用于合成复杂分子。一般来说,组成细胞结构的复杂分子是由小而简单的前体逐步构建的。合成代谢包括三个基本阶段。首先,生产前体,如氨基酸,单糖,类异戊二烯和核苷酸;第二,利用ATP的能量将它们活化成活性形式,第三,将这些前体组装成复杂的分子,例如蛋白质,多糖 ,脂质和核酸。
生物体根据其细胞中构建分子的数量而不同。自养生物(如植物)可以在细胞中构建复杂的有机分子,如二氧化碳和水这样的简单分子组成多糖和蛋白质。另一方面,异营生物需要更复杂的物质来源,如单糖和氨基酸,来产生这些复杂的分子。生物体可以根据能量的最终来源进一步分类:光自养生物和光异养生物,它们从光获得能量,而化能自养生物和化能异养生物从无机氧化反应中获得能量。
4.1 碳固定
光合作用是由阳光和二氧化碳合成碳水化合物。在植物、蓝细菌和藻类中,有氧光合作用分解水,氧气作为废物产生。如上所述,该过程使用由光合反应中心产生的三磷酸腺苷和NADPH来转化一氧化碳变成甘油酸3-磷酸酯然后转化成葡萄糖。这种暗反应是由酶完成的核酮糖-1,5-二磷酸羧化酶/加氧酶作为的一部分加尔文 –本森循环。[47]植物光合作用有三种类型: C3固碳、 C4类二氧化碳固定和 CAM光合作用。不同之处在于二氧化碳到达卡尔文循环的路线,C3工厂正在固定一氧化碳,C4光合作用和CAM光合作用直接结合二氧化碳转化为其他化合物,以适应强烈的阳光和干燥条件。[48]
在光合原核生物中,固碳机制更加多样。在这里,二氧化碳可以被卡尔文固定 –本森循环,一个反向柠檬酸循环,[49]或者乙酰辅酶a的羧基化。[50][51]原核的化能自养生物也固定二氧化碳通过卡尔文 –本森循环,但使用无机化合物的能量来驱动反应。[52]
4.2 碳水化合物和聚糖
在碳水化合物合成代谢中,简单的有机酸可以转化为单糖例如葡萄糖然后用来组装多糖例如淀粉。一代葡萄糖来自像这样的化合物丙酮酸盐,分泌乳汁,甘油,甘油酸3-磷酸酯和氨基酸被称为糖异生作用。糖异生将丙酮酸转化为葡萄糖-6-磷酸通过一系列中间体,其中许多与糖酵解。[53]然而,这种途径不仅仅是糖酵解反向运行,因为几个步骤是由非糖酵解酶催化的。这很重要,因为它允许单独调节葡萄糖的形成和分解,并防止两种途径在底物循环中同时运行。[53][54]
虽然脂肪是储存能量的常见方式,但在脊椎动物如人类中,这些储存中的脂肪酸不能通过糖异生作用转化为葡萄糖,因为这些生物不能将乙酰辅酶A转化为丙酮酸;植物有,但动物没有必要的酶机制。[55]因此,在长期饥饿后,脊椎动物需要从脂肪酸中产生酮体,以替代大脑等不能代谢脂肪酸的组织中的葡萄糖。[56]在其他生物体如植物和细菌中,这种代谢问题通过使用乙醛酸循环来解决,该循环绕过柠檬酸循环中的脱羧步骤,并允许乙酰辅酶a转化为草酰乙酸,由此它可以用于生产葡萄糖。[55]
多糖和聚糖是通过糖基转移酶从活性糖-磷酸供体如尿苷二磷酸葡萄糖(UDP-葡萄糖)到生长多糖上的受体羟基基团顺序添加单糖来制备的。由于底物环上的任何羟基可以是受体,因此产生的多糖可以具有直链或支链结构。[57]产生的多糖本身可以具有结构或代谢功能,或者通过称为寡糖基转移酶的酶转移到脂质和蛋白质中。[58][59]
4.3 脂肪酸、类异戊二烯和类固醇
脂肪酸是由脂肪酸合酶合成的,该合酶聚合然后还原乙酰辅酶A单元。脂肪酸中的酰基链通过添加酰基、将其还原为醇、脱水为烯烃基团、然后再次还原为烷烃基团的反应循环而延伸。脂肪酸生物合成的酶分为两组:在动物和真菌中,所有这些脂肪酸合成酶反应都由单一的多功能 I型蛋白质进行,[60]而在植物质体和细菌中,分离的II型酶执行途径中的每个步骤。[61][62]
萜烯和类异戊二烯是一大类脂质,包括类胡萝卜素并形成最大的植物种类自然产品.[63]这些化合物是由活性前体异戊烯焦磷酸和二甲基烯丙基焦磷酸捐赠的异戊二烯单元组装和修饰而成的。[64]这些前体可以用不同的方法制造。在动物和古菌中,甲羟戊酸途径从乙酰辅酶A产生这些化合物,[65]而在植物和细菌中,非甲羟戊酸途径使用丙酮酸盐和甘油醛3-磷酸作为底物。[64][66]使用这些活化的异戊二烯供体的一个重要反应是类固醇生物合成。这里,异戊二烯单元连接在一起形成鲨烯然后折叠并形成一组环来制作羊毛甾醇。[67]然后,羊毛甾醇可以转化为其他类固醇,如胆固醇和麦角甾醇。[67][68]
4.4 蛋白质
生物体合成20种常见氨基酸的能力各不相同。大多数细菌和植物可以合成所有20种氨基酸,但哺乳动物只能合成11种非必需氨基酸,因此必须从食物中获得9种必需氨基酸。[69]一些简单的寄生虫,如肺炎支原体细菌缺乏所有的氨基酸合成,直接从宿主那里获取氨基酸。[69]所有氨基酸都是由糖酵解、柠檬酸循环或戊糖磷酸途径的中间体合成的。氮由谷氨酸和谷氨酰胺提供。氨基酸合成取决于合适的α-酮酸的形成,然后转氨形成氨基酸。[70]
氨基酸通过肽键链连接在一起制成蛋白质。每个不同的蛋白质都有一个独特的氨基酸残基序列:这是它的一级结构。正如字母表中的字母可以组合成几乎无穷无尽的单词一样,氨基酸可以以不同的序列连接起来,形成种类繁多的蛋白质。蛋白质由氨基酸组成,这些氨基酸通过酯键连接到转移核糖核酸分子上而被激活。这种氨基酰-tRNA前体是在由氨酰tRNA合成酶进行的依赖于 ATP 的反应中产生的。[71]然后这个氨基酰-tRNA是核糖体的底物,核糖体利用信使核糖核酸中的序列信息将氨基酸连接到延伸的蛋白质链上。[72]
4.5 核苷酸合成和回收
核苷酸是由氨基酸、二氧化碳和甲酸在需要大量代谢能量的途径中制成的。[73]因此,大多数生物体都有有效的系统来回收预先形成的核苷酸。[73][74] 嘌呤合成为核苷(碱基附着于核糖)。[75]腺嘌呤和鸟嘌呤都是由前体核苷肌苷单磷酸制备的,它是使用来自氨基酸甘氨酸、谷氨酰胺和天冬氨酸的原子以及来自辅酶的甲酸盐合成的 四氢叶酸。另一方面,嘧啶由碱乳清酸合成,该碱由谷氨酰胺和天冬氨酸形成。[76]
5 异源物和氧化还原代谢编辑
所有生物体都经常暴露于不能用作食物的化合物中,且这些化合物如果积累在细胞中是有害的,因为它们没有代谢功能。这些潜在的破坏性化合物被称为异源物。[77]异源物如合成药物、天然毒物和抗生素可以通过一组异源代谢酶解毒。在人类中,这些酶包括细胞色素P450氧化酶,[78] UDP-葡萄糖醛酸基转移酶,[79]和谷胱甘肽S-转移酶。[80]这个酶系统分三个阶段起作用,首先氧化异源物(第一阶段),然后将水溶性基团偶联到分子上(第二阶段)。然后,经修饰的水溶性异源物可以被泵出细胞,在多细胞生物中,在被排泄之前可以进一步代谢(第三阶段)。在生态学,这些反应在微生物中,对生物降解污染物和生物修复污染的土地和石油泄漏特别重要。[81]许多这些微生物反应与多细胞生物共享,但由于微生物类型的惊人多样性,这些生物能够处理比多细胞生物更广泛的异源物,甚至可以降解持久性有机污染物,如有机氯类杀虫剂化合物。[82]
好氧生物的一个相关问题是氧化应激。[83]这里,包括氧化磷酸化和在蛋白质折叠过程中形成二硫键的过程产生活性氧物种,例如过氧化氢。[84]这些有害的氧化剂被抗氧化剂代谢物如谷胱甘肽和酶如过氧化氢酶和过氧化物酶去除。[85][86]
6 生物体热力学编辑
7 调节和控制编辑
由于大多数生物体的环境在不断变化,代谢反应必须被精细地调节,以维持细胞内一系列恒定的条件,这种条件被称为稳态。[89][90]代谢调节还允许生物体对信号做出反应,并与其环境积极互动。[91]对于理解代谢途径是如何控制,有两个紧密联系的概念很重要。首先是酶在代谢途径中如何响应信号进行增加以及减少的调节,其次这种酶对代谢途径的整体速率(通过途径的通量)所施加的影响作用。[92]例如,酶可以显示活动的巨大变化(例如,充分地调节)但如果这些变化对代谢途径的通量几乎没有影响,那么这种酶就不参与对该途径的控制。[93]
代谢调节有多种水平。在内在调节中,代谢途径自我调节以响应底物或产物水平的变化;例如,产物数量的减少可以增加通过路径的通量,以进行补偿。[92]这种类型的调节通常涉及途径中多种酶活性的变构调节。[94]外源控制涉及多细胞生物中的单个细胞响应来自其他细胞的信号并改变其代谢。这些信号通常以可溶性信使的形式存在,如激素和生长因子,并由细胞表面的特异性受体检测。[95]这些信号在细胞内由第二信使系统进行传递,其通常涉及蛋白质磷酸化[96]
外部控制的一个很好理解的例子是通过胰岛素这一激素来调节葡萄糖代谢。[97]胰岛素是随着血糖水平的升高而产生的。激素与细胞上的胰岛素受体结合,随之激活一系列蛋白激酶,使细胞吸收葡萄糖并将其转化为储存分子,如脂肪酸和糖原。[98]糖原的代谢受两种酶的活动控制,分别是分解糖原的磷酸化酶和制造糖原的糖原合酶。这些酶以相互作用的方式被调节,磷酸化过程抑制糖原合酶,但激活磷酸化酶。胰岛素通过激活蛋白磷酸酶并降低这些酶的磷酸化作用来导致糖原合成。[99]
8 进化编辑
上述代谢的中心途径,如糖酵解和柠檬酸循环,存在于所有生物的三个域中,并呈现于最后一个共同祖先。[100][100]这种共同的祖先细胞是原核,可能是一种产甲烷菌,具有广泛的氨基酸、核苷酸、碳水化合物和脂质代谢。[101][102]在后来的进化中保留这些古老的代谢途径可能是这些反应是它们特定代谢问题的最佳解决方案的结果,例如糖酵解和柠檬酸循环等途径以最少的步骤、高效地生产它们的最终产物。[103][103]基于酶的代谢的第一个途径可能是嘌呤核苷酸代谢的一部分,而以前的代谢途径是古代 RNA世界学说的一部分。[103]
已经提出了许多模型来描述新代谢途径进化的机制。包括向短的祖先途径中顺序添加新的酶,整个代谢途径的重复以及分歧,以及召集预先存在的酶并将其组装成新的反应途径。[104]这些机制的相对重要性尚不清楚,但基因组研究表明,一条途径中的酶可能有共同的祖先,这表明许多途径是以一步一步的方式进化的,由该途径中预先存在的步骤产生了新的功能。[105]另一个模型来自跟踪代谢网络中蛋白质结构进化的研究,这表明酶被普遍召集,借用酶在不同的代谢途径中执行类似的功能(在 MANET数据库中很明显)[106]这些募集过程导致进化的酶马赛克。[107]第三种可能性是代谢的某些部分可能作为“模块”存在,可以在不同的途径中重复使用,并对不同的分子执行类似的功能。[108]
除了新的代谢途径,进化也可能导致代谢功能的丧失。例如,在一些寄生虫的代谢过程中,对生存不重要的代谢过程被丢失,而预先形成的氨基酸、核苷酸和碳水化合物可以从宿主中被清除。[109]在内共生生物中也观察到类似的代谢能力降低。[110]
9 研究和操控编辑
传统上,代谢是通过一种侧重于单个代谢途径的还原论方法来研究的。特别有价值的是在整个生物体、组织和细胞水平上使用放射性示踪剂,它通过识别放射性标记的中间体和产品来确定从前体到最终产品的路径。[111]催化这些化学反应的酶可以被纯化,并研究它们的动力学和对抑制剂的反应。一种平行的方法是识别细胞或组织中的小分子;这些分子的完整集合被称为代谢物组。总的来说,这些研究很好地展示了简单代谢途径的结构和功能,但当应用于更复杂的系统时,如完整细胞的代谢时,这些研究是不够的。[112]
关于复杂的概念代谢网络,右图显示了43种蛋白质和40种代谢物之间的相互作用:基因组序列提供了包含多达45,000个基因的列表。[113]然而,现在可以使用这些基因组数据重建完整的生化反应网络,并产生更多的整体数学模型来解释和预测它们的行为。[114]当用于将通过经典方法获得的途径和代谢物数据与来自蛋白质组学和 DNA微阵列研究的基因表达数据整合时,这些模型尤其强大。[115]利用这些技术,人类代谢模型现已产生,这将指导未来的药物发现和生化研究。[116]这些模型现在用于网络分析,将人类疾病分成共享共同蛋白质或代谢物的组。[117][118]
细菌代谢网络是领结组织的一个显著例子[119][120][121],一种能够输入多种营养物质并使用相对较少的中间通用介质生产多种产物和复杂大分子的体系结构。
该信息的主要技术应用是代谢工程。这里,生物体如酵母、植物或细菌被基因改良以使它们在生物技术中更有用,并有助于生产药物,如抗生素或工业化学品,如 1,3-丙二醇和莽草酸。[122]这些基因改良通常旨在减少用于生产产物的能量,提高产量,减少废物的产生。[123]
10 历史编辑
术语新陈代谢源自希腊语μεταβολισμός –“新陈代谢”代表“改变”或“推翻”。[124]
10.1 希腊哲学
亚里士多德《论动物部分》列出他对代谢的足够详细的观点,以建立一个开放的流模型。他认为,在这个过程的每个阶段,食物中的物质都会发生转化,热量作为经典的火元素被释放出来,剩余的物质作为尿液、胆汁或粪便排出。[125]
10.2 伊斯兰医学
伊本·纳菲在他公元1260年的著作《法源论纲·卡米利亚·菲拉·纳巴维耶》(又名《卡米勒先知传记论》)中描述了新陈代谢,其中包括以下语句:“身体及其各部分都处于持续的溶解和营养状态,因此它们不可避免地正在经历永久的变化。”[126]
10.3 科学方法的应用
代谢科学研究的历史跨越了几个世纪,已经从早期研究中检查整个动物转移到现代生物化学中检查单独的代谢反应。第一个被控制的人体新陈代谢的实验由Santorio Santorio发布于1614年他的书中Ars de statica medicina。[127]他描述自己进食、睡眠、工作、性、禁食、饮酒和排泄前后的体重变化。他发现他摄入的大部分食物都是通过他所谓的“无知觉的汗水”流失的。
在这些早期研究中,这些代谢过程的机制还没有被确定,人们认为生命力可以使活组织产生活力。[128]19世纪,路易·巴斯德在研究酵母将糖发酵为酒精时得出结论,发酵是由酵母细胞内的物质催化的,他称之为“发酵物”。他写道,“酒精发酵是一种与酵母细胞的生命和组织相关的行为,而不是与细胞的死亡或腐败相关。”[129]这一发现,连同弗里德里希·维勒在1828年发表的一篇关于尿素化学合成的论文,[130]并且值得注意的是,它是由完全无机前体制备的第一种有机化合物。这证明了细胞中发现的有机化合物和化学反应在原则上与其它化学的部分没有区别。
是爱德华·比希纳在20世纪初发现了酶,将代谢的化学反应研究与细胞的生物学研究区分开,标志着生物化学的开端。[131]在整个20世纪初,生物化学知识的数量迅速增长。这些现代生物化学家中最多产的一个是汉斯·克雷布斯,他对代谢研究做出了巨大贡献。[132]他发现了尿素循环,后来与汉斯·科恩伯格一起研究柠檬酸循环和乙醛酸循环。[133][134]现代生物化学研究极大得益于新技术的发展,如色谱、 X射线衍射、核磁共振波谱、放射性同位素标记、电子显微镜和分子动力学模拟。这些技术使得细胞中的许多分子和代谢途径的发现和详细分析成为可能。
参考文献
- [1]
^Pace NR (January 2001). "The universal nature of biochemistry". Proc. Natl. Acad. Sci. U.S.A. 98 (3): 805–8. Bibcode:2001PNAS...98..805P. doi:10.1073/pnas.98.3.805. PMC 33372. PMID 11158550..
- [2]
^Michie K, Löwe J (2006). "Dynamic filaments of the bacterial cytoskeleton". Annu Rev Biochem. 75: 467–92. doi:10.1146/annurev.biochem.75.103004.142452. PMID 16756499..
- [3]
^Kelleher J, Bryan 3rd, B, Mallet R, Holleran A, Murphy A, and Fiskum G (1987). "Analysis of tricarboxylic acid-cycle metabolism of hepatoma cells by comparison of 14CO2 ratios". Biochem J. 246 (3): 633–639. doi:10.1042/bj2460633. PMC 1148327. PMID 3120698.CS1 maint: Uses authors parameter (link).
- [4]
^Hothersall, J & Ahmed, A (2013). "Metabolic fate of the increased yeast amino acid uptake subsequent to catabolite derepression". J Amino Acids. 2013: 1–7. doi:10.1155/2013/461901. PMC 3575661. PMID 23431419..
- [5]
^Fahy E, Subramaniam S, Brown H, Glass C, Merrill A, Murphy R, Raetz C, Russell D, Seyama Y, Shaw W, Shimizu T, Spener F, van Meer G, VanNieuwenhze M, White S, Witztum J, Dennis E (2005). "A comprehensive classification system for lipids". J Lipid Res. 46 (5): 839–61. doi:10.1194/jlr.E400004-JLR200. PMID 15722563..
- [6]
^"Nomenclature of Lipids". IUPAC-IUB Commission on Biochemical Nomenclature (CBN). Retrieved 8 March 2007..
- [7]
^Hegardt F (1999). "Mitochondrial 3-hydroxy-3-methylglutaryl-CoA synthase: a control enzyme in ketogenesis". Biochem J. 338 (Pt 3): 569–82. doi:10.1042/0264-6021:3380569. PMC 1220089. PMID 10051425..
- [8]
^Raman R, Raguram S, Venkataraman G, Paulson J, Sasisekharan R (2005). "Glycomics: an integrated systems approach to structure-function relationships of glycans". Nat Methods. 2 (11): 817–24. doi:10.1038/nmeth807. PMID 16278650..
- [9]
^Sierra S, Kupfer B, Kaiser R (2005). "Basics of the virology of HIV-1 and its replication". J Clin Virol. 34 (4): 233–44. doi:10.1016/j.jcv.2005.09.004. PMID 16198625..
- [10]
^Wimmer M, Rose I (1978). "Mechanisms of enzyme-catalyzed group transfer reactions". Annu Rev Biochem. 47: 1031–78. doi:10.1146/annurev.bi.47.070178.005123. PMID 354490..
- [11]
^Mitchell P (1979). "The Ninth Sir Hans Krebs Lecture. Compartmentation and communication in living systems. Ligand conduction: a general catalytic principle in chemical, osmotic and chemiosmotic reaction systems". Eur J Biochem. 95 (1): 1–20. doi:10.1111/j.1432-1033.1979.tb12934.x. PMID 378655..
- [12]
^Coulston, Ann; Kerner, John; Hattner, JoAnn; Srivastava, Ashini (2006). "Nutrition Principles and Clinical Nutrition". Stanford School of Medicine Nutrition Courses. SUMMIT..
- [13]
^Pollak N, Dölle C, Ziegler M (2007). "The power to reduce: pyridine nucleotides – small molecules with a multitude of functions". Biochem J. 402 (2): 205–18. doi:10.1042/BJ20061638. PMC 1798440. PMID 17295611..
- [14]
^Heymsfield S, Waki M, Kehayias J, Lichtman S, Dilmanian F, Kamen Y, Wang J, Pierson R (1991). "Chemical and elemental analysis of humans in vivo using improved body composition models". Am J Physiol. 261 (2 Pt 1): E190–8. doi:10.1152/ajpendo.1991.261.2.E190. PMID 1872381..
- [15]
^Sychrová H (2004). "Yeast as a model organism to study transport and homeostasis of alkali metal cations" (PDF). Physiol Res. 53 Suppl 1: S91–8. PMID 15119939..
- [16]
^Levitan I (1988). "Modulation of ion channels in neurons and other cells". Annu Rev Neurosci. 11: 119–36. doi:10.1146/annurev.ne.11.030188.001003. PMID 2452594..
- [17]
^Dulhunty A (2006). "Excitation-contraction coupling from the 1950s into the new millennium". Clin Exp Pharmacol Physiol. 33 (9): 763–72. doi:10.1111/j.1440-1681.2006.04441.x. PMID 16922804..
- [18]
^Mahan D, Shields R (1998). "Macro- and micromineral composition of pigs from birth to 145 kilograms of body weight" (PDF). J Anim Sci. 76 (2): 506–12. doi:10.2527/1998.762506x. PMID 9498359..
- [19]
^Husted S, Mikkelsen B, Jensen J, Nielsen N (2004). "Elemental fingerprint analysis of barley (Hordeum vulgare) using inductively coupled plasma mass spectrometry, isotope-ratio mass spectrometry, and multivariate statistics". Anal Bioanal Chem. 378 (1): 171–82. doi:10.1007/s00216-003-2219-0. PMID 14551660..
- [20]
^Finney L, O'Halloran T (2003). "Transition metal speciation in the cell: insights from the chemistry of metal ion receptors". Science. 300 (5621): 931–6. Bibcode:2003Sci...300..931F. doi:10.1126/science.1085049. PMID 12738850..
- [21]
^Cousins R, Liuzzi J, Lichten L (2006). "Mammalian zinc transport, trafficking, and signals". J Biol Chem. 281 (34): 24085–9. doi:10.1074/jbc.R600011200. PMID 16793761..
- [22]
^Dunn L, Rahmanto Y, Richardson D (2007). "Iron uptake and metabolism in the new millennium". Trends Cell Biol. 17 (2): 93–100. doi:10.1016/j.tcb.2006.12.003. PMID 17194590..
- [23]
^Nealson K, Conrad P (1999). "Life: past, present and future". Philos Trans R Soc Lond B Biol Sci. 354 (1392): 1923–39. doi:10.1098/rstb.1999.0532. PMC 1692713. PMID 10670014..
- [24]
^Häse C, Finkelstein R (December 1993). "Bacterial extracellular zinc-containing metalloproteases". Microbiol Rev. 57 (4): 823–37. PMC 372940. PMID 8302217..
- [25]
^Gupta R, Gupta N, Rathi P (2004). "Bacterial lipases: an overview of production, purification and biochemical properties". Appl Microbiol Biotechnol. 64 (6): 763–81. doi:10.1007/s00253-004-1568-8. PMID 14966663..
- [26]
^Hoyle T (1997). "The digestive system: linking theory and practice". Br J Nurs. 6 (22): 1285–91. doi:10.12968/bjon.1997.6.22.1285. PMID 9470654..
- [27]
^Souba W, Pacitti A (1992). "How amino acids get into cells: mechanisms, models, menus, and mediators". JPEN J Parenter Enteral Nutr. 16 (6): 569–78. doi:10.1177/0148607192016006569. PMID 1494216..
- [28]
^Barrett M, Walmsley A, Gould G (1999). "Structure and function of facilitative sugar transporters". Curr Opin Cell Biol. 11 (4): 496–502. doi:10.1016/S0955-0674(99)80072-6. PMID 10449337..
- [29]
^Bell G, Burant C, Takeda J, Gould G (1993). "Structure and function of mammalian facilitative sugar transporters". J Biol Chem. 268 (26): 19161–4. PMID 8366068..
- [30]
^Wipperman, Matthew, F.; Thomas, Suzanne, T.; Sampson, Nicole, S. (2014). "Pathogen roid rage: Cholesterol utilization by Mycobacterium tuberculosis". Crit. Rev. Biochem. Mol. Biol. 49 (4): 269–93. doi:10.3109/10409238.2014.895700. PMC 4255906. PMID 24611808..
- [31]
^Sakami W, Harrington H (1963). "Amino acid metabolism". Annu Rev Biochem. 32: 355–98. doi:10.1146/annurev.bi.32.070163.002035. PMID 14144484..
- [32]
^Brosnan J (2000). "Glutamate, at the interface between amino acid and carbohydrate metabolism". J Nutr. 130 (4S Suppl): 988S–90S. doi:10.1093/jn/130.4.988S. PMID 10736367..
- [33]
^Young V, Ajami A (2001). "Glutamine: the emperor or his clothes?". J Nutr. 131 (9 Suppl): 2449S–59S, discussion 2486S–7S. doi:10.1093/jn/131.9.2449S. PMID 11533293..
- [34]
^Hosler J, Ferguson-Miller S, Mills D (2006). "Energy Transduction: Proton Transfer Through the Respiratory Complexes". Annu Rev Biochem. 75: 165–87. doi:10.1146/annurev.biochem.75.062003.101730. PMC 2659341. PMID 16756489..
- [35]
^Schultz B, Chan S (2001). "Structures and proton-pumping strategies of mitochondrial respiratory enzymes". Annu Rev Biophys Biomol Struct. 30: 23–65. doi:10.1146/annurev.biophys.30.1.23. PMID 11340051..
- [36]
^Capaldi R, Aggeler R (2002). "Mechanism of the F(1)F(0)-type ATP synthase, a biological rotary motor". Trends Biochem Sci. 27 (3): 154–60. doi:10.1016/S0968-0004(01)02051-5. PMID 11893513..
- [37]
^Dimroth P, von Ballmoos C, Meier T (March 2006). "Catalytic and mechanical cycles in F-ATP synthases: Fourth in the Cycles Review Series". EMBO Rep. 7 (3): 276–82. doi:10.1038/sj.embor.7400646. PMC 1456893. PMID 16607397..
- [38]
^Friedrich C (1998). Physiology and genetics of sulfur-oxidizing bacteria. Adv Microb Physiol. Advances in Microbial Physiology. 39. pp. 235–89. doi:10.1016/S0065-2911(08)60018-1. ISBN 978-0-12-027739-1. PMID 9328649..
- [39]
^Jetten M, Strous M, van de Pas-Schoonen K, Schalk J, van Dongen U, van de Graaf A, Logemann S, Muyzer G, van Loosdrecht M, Kuenen J (1998). "The anaerobic oxidation of ammonium". FEMS Microbiol Rev. 22 (5): 421–37. doi:10.1111/j.1574-6976.1998.tb00379.x. PMID 9990725..
- [40]
^Simon J (2002). "Enzymology and bioenergetics of respiratory nitrite ammonification". FEMS Microbiol Rev. 26 (3): 285–309. doi:10.1111/j.1574-6976.2002.tb00616.x. PMID 12165429..
- [41]
^Conrad R (1996). "Soil microorganisms as controllers of atmospheric trace gases (H2, CO, CH4, OCS, N2O, and NO)". Microbiol Rev. 60 (4): 609–40. PMC 239458. PMID 8987358..
- [42]
^Barea J, Pozo M, Azcón R, Azcón-Aguilar C (2005). "Microbial co-operation in the rhizosphere". J Exp Bot. 56 (417): 1761–78. doi:10.1093/jxb/eri197. PMID 15911555..
- [43]
^van der Meer M, Schouten S, Bateson M, Nübel U, Wieland A, Kühl M, de Leeuw J, Sinninghe Damsté J, Ward D (July 2005). "Diel Variations in Carbon Metabolism by Green Nonsulfur-Like Bacteria in Alkaline Siliceous Hot Spring Microbial Mats from Yellowstone National Park". Appl Environ Microbiol. 71 (7): 3978–86. doi:10.1128/AEM.71.7.3978-3986.2005. PMC 1168979. PMID 16000812..
- [44]
^Tichi M, Tabita F (2001). "Interactive Control of Rhodobacter capsulatus Redox-Balancing Systems during Phototrophic Metabolism". J Bacteriol. 183 (21): 6344–54. doi:10.1128/JB.183.21.6344-6354.2001. PMC 100130. PMID 11591679..
- [45]
^Allen J, Williams J (1998). "Photosynthetic reaction centers". FEBS Lett. 438 (1–2): 5–9. doi:10.1016/S0014-5793(98)01245-9. PMID 9821949..
- [46]
^Nelson N, Ben-Shem A (2004). "The complex architecture of oxygenic photosynthesis". Nat Rev Mol Cell Biol. 5 (12): 971–82. doi:10.1038/nrm1525. PMID 15573135..
- [47]
^Miziorko H, Lorimer G (1983). "Ribulose-1,5-bisphosphate carboxylase-oxygenase". Annu Rev Biochem. 52: 507–35. doi:10.1146/annurev.bi.52.070183.002451. PMID 6351728..
- [48]
^Dodd A, Borland A, Haslam R, Griffiths H, Maxwell K (2002). "Crassulacean acid metabolism: plastic, fantastic". J Exp Bot. 53 (369): 569–80. doi:10.1093/jexbot/53.369.569. PMID 11886877..
- [49]
^Hügler M, Wirsen C, Fuchs G, Taylor C, Sievert S (May 2005). "Evidence for Autotrophic CO2 Fixation via the Reductive Tricarboxylic Acid Cycle by Members of the ɛ Subdivision of Proteobacteria". J Bacteriol. 187 (9): 3020–7. doi:10.1128/JB.187.9.3020-3027.2005. PMC 1082812. PMID 15838028..
- [50]
^Strauss G, Fuchs G (1993). "Enzymes of a novel autotrophic CO2 fixation pathway in the phototrophic bacterium Chloroflexus aurantiacus, the 3-hydroxypropionate cycle". Eur J Biochem. 215 (3): 633–43. doi:10.1111/j.1432-1033.1993.tb18074.x. PMID 8354269..
- [51]
^Wood H (1991). "Life with CO or CO2 and H2 as a source of carbon and energy". FASEB J. 5 (2): 156–63. doi:10.1096/fasebj.5.2.1900793. PMID 1900793..
- [52]
^Shively J, van Keulen G, Meijer W (1998). "Something from almost nothing: carbon dioxide fixation in chemoautotrophs". Annu Rev Microbiol. 52: 191–230. doi:10.1146/annurev.micro.52.1.191. PMID 9891798..
- [53]
^Bouché C, Serdy S, Kahn C, Goldfine A (2004). "The cellular fate of glucose and its relevance in type 2 diabetes". Endocr Rev. 25 (5): 807–30. doi:10.1210/er.2003-0026. PMID 15466941. Archived from the original on 4 December 2012. Retrieved 15 March 2007..
- [54]
^Pilkis S, el-Maghrabi M, Claus T (1990). "Fructose-2,6-bisphosphate in control of hepatic gluconeogenesis. From metabolites to molecular genetics". Diabetes Care. 13 (6): 582–99. doi:10.2337/diacare.13.6.582. PMID 2162755..
- [55]
^Ensign S (2006). "Revisiting the glyoxylate cycle: alternate pathways for microbial acetate assimilation". Mol Microbiol. 61 (2): 274–6. doi:10.1111/j.1365-2958.2006.05247.x. PMID 16856935..
- [56]
^Finn P, Dice J (2006). "Proteolytic and lipolytic responses to starvation". Nutrition. 22 (7–8): 830–44. doi:10.1016/j.nut.2006.04.008. PMID 16815497..
- [57]
^Rademacher T, Parekh R, Dwek R (1988). "Glycobiology". Annu Rev Biochem. 57: 785–838. doi:10.1146/annurev.bi.57.070188.004033. PMID 3052290..
- [58]
^Opdenakker G, Rudd P, Ponting C, Dwek R (1993). "Concepts and principles of glycobiology". FASEB J. 7 (14): 1330–7. doi:10.1096/fasebj.7.14.8224606. PMID 8224606..
- [59]
^McConville M, Menon A (2000). "Recent developments in the cell biology and biochemistry of glycosylphosphatidylinositol lipids (review)". Mol Membr Biol. 17 (1): 1–16. doi:10.1080/096876800294443. PMID 10824734..
- [60]
^Chirala S, Wakil S (2004). "Structure and function of animal fatty acid synthase". Lipids. 39 (11): 1045–53. doi:10.1007/s11745-004-1329-9. PMID 15726818..
- [61]
^White S, Zheng J, Zhang Y (2005). "The structural biology of type II fatty acid biosynthesis". Annu Rev Biochem. 74: 791–831. doi:10.1146/annurev.biochem.74.082803.133524. PMID 15952903..
- [62]
^Ohlrogge J, Jaworski J (1997). "Regulation of fatty acid synthesis". Annu Rev Plant Physiol Plant Mol Biol. 48: 109–136. doi:10.1146/annurev.arplant.48.1.109. PMID 15012259..
- [63]
^Dubey V, Bhalla R, Luthra R (2003). "An overview of the non-mevalonate pathway for terpenoid biosynthesis in plants" (PDF). J Biosci. 28 (5): 637–46. doi:10.1007/BF02703339. PMID 14517367. Archived from the original (PDF) on 15 April 2007..
- [64]
^Kuzuyama T, Seto H (2003). "Diversity of the biosynthesis of the isoprene units". Nat Prod Rep. 20 (2): 171–83. doi:10.1039/b109860h. PMID 12735695..
- [65]
^Grochowski L, Xu H, White R (May 2006). "Methanocaldococcus jannaschii Uses a Modified Mevalonate Pathway for Biosynthesis of Isopentenyl Diphosphate". J Bacteriol. 188 (9): 3192–8. doi:10.1128/JB.188.9.3192-3198.2006. PMC 1447442. PMID 16621811..
- [66]
^Lichtenthaler H (1999). "The 1-Ddeoxy-D-xylulose-5-phosphate pathway of isoprenoid biosynthesis in plants". Annu Rev Plant Physiol Plant Mol Biol. 50: 47–65. doi:10.1146/annurev.arplant.50.1.47. PMID 15012203..
- [67]
^Schroepfer G (1981). "Sterol biosynthesis". Annu Rev Biochem. 50: 585–621. doi:10.1146/annurev.bi.50.070181.003101. PMID 7023367..
- [68]
^Lees N, Skaggs B, Kirsch D, Bard M (1995). "Cloning of the late genes in the ergosterol biosynthetic pathway of Saccharomyces cerevisiae—a review". Lipids. 30 (3): 221–6. doi:10.1007/BF02537824. PMID 7791529..
- [69]
^Nelson, David L.; Michael M. Cox (2005). Lehninger Principles of Biochemistry. New York: W. H. Freeman and company. p. 841. ISBN 978-0-7167-4339-2..
- [70]
^Guyton, Arthur C.; John E. Hall (2006). Textbook of Medical Physiology. Philadelphia: Elsevier. pp. 855–6. ISBN 978-0-7216-0240-0..
- [71]
^Ibba M, Söll D (2001). "The renaissance of aminoacyl-tRNA synthesis". EMBO Rep. 2 (5): 382–7. doi:10.1093/embo-reports/kve095. PMC 1083889. PMID 11375928. Archived from the original on 1 May 2011..
- [72]
^Lengyel P, Söll D (1969). "Mechanism of protein biosynthesis". Bacteriol Rev. 33 (2): 264–301. PMC 378322. PMID 4896351..
- [73]
^Rudolph F (1994). "The biochemistry and physiology of nucleotides". J Nutr. 124 (1 Suppl): 124S–127S. doi:10.1093/jn/124.suppl_1.124S. PMID 8283301. Zrenner R, Stitt M, Sonnewald U, Boldt R (2006). "Pyrimidine and purine biosynthesis and degradation in plants". Annu Rev Plant Biol. 57: 805–36. doi:10.1146/annurev.arplant.57.032905.105421. PMID 16669783..
- [74]
^Stasolla C, Katahira R, Thorpe T, Ashihara H (2003). "Purine and pyrimidine nucleotide metabolism in higher plants". J Plant Physiol. 160 (11): 1271–95. doi:10.1078/0176-1617-01169. PMID 14658380..
- [75]
^Davies O, Mendes P, Smallbone K, Malys N (2012). "Characterisation of multiple substrate-specific (d)ITP/(d)XTPase and modelling of deaminated purine nucleotide metabolism". BMB Reports. 45 (4): 259–64. doi:10.5483/BMBRep.2012.45.4.259. PMID 22531138..
- [76]
^Smith J (1995). "Enzymes of nucleotide synthesis". Curr Opin Struct Biol. 5 (6): 752–7. doi:10.1016/0959-440X(95)80007-7. PMID 8749362..
- [77]
^Testa B, Krämer S (2006). "The biochemistry of drug metabolism—an introduction: part 1. Principles and overview". Chem Biodivers. 3 (10): 1053–101. doi:10.1002/cbdv.200690111. PMID 17193224..
- [78]
^Danielson P (2002). "The cytochrome P450 superfamily: biochemistry, evolution and drug metabolism in humans". Curr Drug Metab. 3 (6): 561–97. doi:10.2174/1389200023337054. PMID 12369887..
- [79]
^King C, Rios G, Green M, Tephly T (2000). "UDP-glucuronosyltransferases". Curr Drug Metab. 1 (2): 143–61. doi:10.2174/1389200003339171. PMID 11465080..
- [80]
^Sheehan D, Meade G, Foley V, Dowd C (November 2001). "Structure, function and evolution of glutathione transferases: implications for classification of non-mammalian members of an ancient enzyme superfamily". Biochem J. 360 (Pt 1): 1–16. doi:10.1042/0264-6021:3600001. PMC 1222196. PMID 11695986..
- [81]
^Galvão T, Mohn W, de Lorenzo V (2005). "Exploring the microbial biodegradation and biotransformation gene pool". Trends Biotechnol. 23 (10): 497–506. doi:10.1016/j.tibtech.2005.08.002. PMID 16125262..
- [82]
^Janssen D, Dinkla I, Poelarends G, Terpstra P (2005). "Bacterial degradation of xenobiotic compounds: evolution and distribution of novel enzyme activities". Environ Microbiol. 7 (12): 1868–82. doi:10.1111/j.1462-2920.2005.00966.x. PMID 16309386..
- [83]
^Davies K (1995). "Oxidative stress: the paradox of aerobic life". Biochem Soc Symp. 61: 1–31. doi:10.1042/bss0610001. PMID 8660387..
- [84]
^Tu B, Weissman J (2004). "Oxidative protein folding in eukaryotes: mechanisms and consequences". J Cell Biol. 164 (3): 341–6. doi:10.1083/jcb.200311055. PMC 2172237. PMID 14757749..
- [85]
^Sies H (1997). "Oxidative stress: oxidants and antioxidants" (PDF). Exp Physiol. 82 (2): 291–5. doi:10.1113/expphysiol.1997.sp004024. PMID 9129943..
- [86]
^Vertuani S, Angusti A, Manfredini S (2004). "The antioxidants and pro-antioxidants network: an overview". Curr Pharm Des. 10 (14): 1677–94. doi:10.2174/1381612043384655. PMID 15134565..
- [87]
^von Stockar U, Liu J (1999). "Does microbial life always feed on negative entropy? Thermodynamic analysis of microbial growth". Biochim Biophys Acta. 1412 (3): 191–211. doi:10.1016/S0005-2728(99)00065-1. PMID 10482783..
- [88]
^Demirel Y, Sandler S (2002). "Thermodynamics and bioenergetics". Biophys Chem. 97 (2–3): 87–111. doi:10.1016/S0301-4622(02)00069-8. PMID 12050002..
- [89]
^Albert R (2005). "Scale-free networks in cell biology". J Cell Sci. 118 (Pt 21): 4947–57. arXiv:q-bio/0510054. doi:10.1242/jcs.02714. PMID 16254242..
- [90]
^Brand M (1997). "Regulation analysis of energy metabolism". J Exp Biol. 200 (Pt 2): 193–202. PMID 9050227..
- [91]
^Soyer O, Salathé M, Bonhoeffer S (2006). "Signal transduction networks: topology, response and biochemical processes". J Theor Biol. 238 (2): 416–25. doi:10.1016/j.jtbi.2005.05.030. PMID 16045939..
- [92]
^Salter M, Knowles R, Pogson C (1994). "Metabolic control". Essays Biochem. 28: 1–12. PMID 7925313..
- [93]
^Westerhoff H, Groen A, Wanders R (1984). "Modern theories of metabolic control and their applications (review)". Biosci Rep. 4 (1): 1–22. doi:10.1007/BF01120819. PMID 6365197..
- [94]
^Fell D, Thomas S (1995). "Physiological control of metabolic flux: the requirement for multisite modulation". Biochem J. 311 (Pt 1): 35–9. doi:10.1042/bj3110035. PMC 1136115. PMID 7575476..
- [95]
^Hendrickson W (2005). "Transduction of biochemical signals across cell membranes". Q Rev Biophys. 38 (4): 321–30. doi:10.1017/S0033583506004136. PMID 16600054..
- [96]
^Cohen P (2000). "The regulation of protein function by multisite phosphorylation—a 25 year update". Trends Biochem Sci. 25 (12): 596–601. doi:10.1016/S0968-0004(00)01712-6. PMID 11116185..
- [97]
^Lienhard G, Slot J, James D, Mueckler M (1992). "How cells absorb glucose". Sci Am. 266 (1): 86–91. Bibcode:1992SciAm.266a..86L. doi:10.1038/scientificamerican0192-86. PMID 1734513..
- [98]
^Roach P (2002). "Glycogen and its metabolism". Curr Mol Med. 2 (2): 101–20. doi:10.2174/1566524024605761. PMID 11949930..
- [99]
^Newgard C, Brady M, O'Doherty R, Saltiel A (2000). "Organizing glucose disposal: emerging roles of the glycogen targeting subunits of protein phosphatase-1" (PDF). Diabetes. 49 (12): 1967–77. doi:10.2337/diabetes.49.12.1967. PMID 11117996..
- [100]
^Smith E, Morowitz H (2004). "Universality in intermediary metabolism". Proc Natl Acad Sci USA. 101 (36): 13168–73. Bibcode:2004PNAS..10113168S. doi:10.1073/pnas.0404922101. PMC 516543. PMID 15340153..
- [101]
^Koch A (1998). How did bacteria come to be?. Adv Microb Physiol. Advances in Microbial Physiology. 40. pp. 353–99. doi:10.1016/S0065-2911(08)60135-6. ISBN 978-0-12-027740-7. PMID 9889982..
- [102]
^Ouzounis C, Kyrpides N (1996). "The emergence of major cellular processes in evolution". FEBS Lett. 390 (2): 119–23. doi:10.1016/0014-5793(96)00631-X. PMID 8706840..
- [103]
^Ebenhöh O, Heinrich R (2001). "Evolutionary optimization of metabolic pathways. Theoretical reconstruction of the stoichiometry of ATP and NADH producing systems". Bull Math Biol. 63 (1): 21–55. doi:10.1006/bulm.2000.0197. PMID 11146883..
- [104]
^Schmidt S, Sunyaev S, Bork P, Dandekar T (2003). "Metabolites: a helping hand for pathway evolution?". Trends Biochem Sci. 28 (6): 336–41. doi:10.1016/S0968-0004(03)00114-2. PMID 12826406..
- [105]
^Light S, Kraulis P (2004). "Network analysis of metabolic enzyme evolution in Escherichia coli". BMC Bioinformatics. 5: 15. doi:10.1186/1471-2105-5-15. PMC 394313. PMID 15113413. Alves R, Chaleil R, Sternberg M (2002). "Evolution of enzymes in metabolism: a network perspective". J Mol Biol. 320 (4): 751–70. doi:10.1016/S0022-2836(02)00546-6. PMID 12095253..
- [106]
^Kim HS, Mittenthal JE, Caetano-Anolles G (2006). "MANET: tracing evolution of protein architecture in metabolic networks". BMC Bioinformatics. 7: 351. doi:10.1186/1471-2105-7-351. PMC 1559654. PMID 16854231..
- [107]
^Teichmann SA, Rison SC, Thornton JM, Riley M, Gough J, Chothia C (2001). "Small-molecule metabolsim: an enzyme mosaic". Trends Biotechnol. 19 (12): 482–6. doi:10.1016/S0167-7799(01)01813-3. PMID 11711174..
- [108]
^Spirin V, Gelfand M, Mironov A, Mirny L (June 2006). "A metabolic network in the evolutionary context: Multiscale structure and modularity". Proc Natl Acad Sci USA. 103 (23): 8774–9. Bibcode:2006PNAS..103.8774S. doi:10.1073/pnas.0510258103. PMC 1482654. PMID 16731630..
- [109]
^Lawrence J (2005). "Common themes in the genome strategies of pathogens". Curr Opin Genet Dev. 15 (6): 584–8. doi:10.1016/j.gde.2005.09.007. PMID 16188434. Wernegreen J (2005). "For better or worse: genomic consequences of intracellular mutualism and parasitism". Curr Opin Genet Dev. 15 (6): 572–83. doi:10.1016/j.gde.2005.09.013. PMID 16230003..
- [110]
^Pál C, Papp B, Lercher M, Csermely P, Oliver S, Hurst L (2006). "Chance and necessity in the evolution of minimal metabolic networks". Nature. 440 (7084): 667–70. Bibcode:2006Natur.440..667P. doi:10.1038/nature04568. PMID 16572170..
- [111]
^Rennie M (1999). "An introduction to the use of tracers in nutrition and metabolism". Proc Nutr Soc. 58 (4): 935–44. doi:10.1017/S002966519900124X. PMID 10817161..
- [112]
^Phair R (1997). "Development of kinetic models in the nonlinear world of molecular cell biology". Metabolism. 46 (12): 1489–95. doi:10.1016/S0026-0495(97)90154-2. PMID 9439549..
- [113]
^Sterck L, Rombauts S, Vandepoele K, Rouzé P, Van de Peer Y (2007). "How many genes are there in plants (... and why are they there)?". Curr Opin Plant Biol. 10 (2): 199–203. doi:10.1016/j.pbi.2007.01.004. PMID 17289424..
- [114]
^Borodina I, Nielsen J (2005). "From genomes to in silico cells via metabolic networks". Curr Opin Biotechnol. 16 (3): 350–5. doi:10.1016/j.copbio.2005.04.008. PMID 15961036..
- [115]
^Gianchandani E, Brautigan D, Papin J (2006). "Systems analyses characterize integrated functions of biochemical networks". Trends Biochem Sci. 31 (5): 284–91. doi:10.1016/j.tibs.2006.03.007. PMID 16616498..
- [116]
^Duarte NC, Becker SA, Jamshidi N, et al. (February 2007). "Global reconstruction of the human metabolic network based on genomic and bibliomic data". Proc. Natl. Acad. Sci. U.S.A. 104 (6): 1777–82. Bibcode:2007PNAS..104.1777D. doi:10.1073/pnas.0610772104. PMC 1794290. PMID 17267599..
- [117]
^Goh KI, Cusick ME, Valle D, Childs B, Vidal M, Barabási AL (May 2007). "The human disease network". Proc. Natl. Acad. Sci. U.S.A. 104 (21): 8685–90. Bibcode:2007PNAS..104.8685G. doi:10.1073/pnas.0701361104. PMC 1885563. PMID 17502601..
- [118]
^Lee DS, Park J, Kay KA, Christakis NA, Oltvai ZN, Barabási AL (July 2008). "The implications of human metabolic network topology for disease comorbidity". Proc. Natl. Acad. Sci. U.S.A. 105 (29): 9880–9885. Bibcode:2008PNAS..105.9880L. doi:10.1073/pnas.0802208105. PMC 2481357. PMID 18599447..
- [119]
^Csete M, Doyle J (2004). "Bow ties, metabolism and disease". Trends Biotechnol. 22 (9): 446–50. doi:10.1016/j.tibtech.2004.07.007. PMID 15331224..
- [120]
^Ma HW, Zeng AP (2003). "The connectivity structure, giant strong component and centrality of metabolic networks". Bioinformatics. 19 (11): 1423–30. CiteSeerX 10.1.1.605.8964. doi:10.1093/bioinformatics/btg177. PMID 12874056..
- [121]
^Zhao J, Yu H, Luo JH, Cao ZW, Li YX (2006). "Hierarchical modularity of nested bow-ties in metabolic networks". BMC Bioinformatics. 7: 386. doi:10.1186/1471-2105-7-386. PMC 1560398. PMID 16916470..
- [122]
^Thykaer J, Nielsen J (2003). "Metabolic engineering of beta-lactam production". Metab Eng. 5 (1): 56–69. doi:10.1016/S1096-7176(03)00003-X. PMID 12749845. González-Pajuelo M, Meynial-Salles I, Mendes F, Andrade J, Vasconcelos I, Soucaille P (2005). "Metabolic engineering of Clostridium acetobutylicum for the industrial production of 1,3-propanediol from glycerol". Metab Eng. 7 (5–6): 329–36. doi:10.1016/j.ymben.2005.06.001. PMID 16095939. Krämer M, Bongaerts J, Bovenberg R, Kremer S, Müller U, Orf S, Wubbolts M, Raeven L (2003). "Metabolic engineering for microbial production of shikimic acid". Metab Eng. 5 (4): 277–83. doi:10.1016/j.ymben.2003.09.001. PMID 14642355..
- [123]
^Koffas M, Roberge C, Lee K, Stephanopoulos G (1999). "Metabolic engineering". Annu Rev Biomed Eng. 1: 535–57. doi:10.1146/annurev.bioeng.1.1.535. PMID 11701499..
- [124]
^"Metabolism". The Online Etymology Dictionary. Retrieved 20 February 2007..
- [125]
^Leroi, Armand Marie (2014). The Lagoon: How Aristotle Invented Science. Bloomsbury. pp. 400–401. ISBN 978-1-4088-3622-4..
- [126]
^阿布·沙迪·鲁比博士(1982),"作为哲学家的伊本·纳菲",伊本·纳菲专题讨论会,第二届伊斯兰医学国际会议:科威特伊斯兰医学组织(参见伊本·纳菲作为哲学家,《伊斯兰世界百科全书[1》).
- [127]
^Eknoyan G (1999). "Santorio Sanctorius (1561–1636) – founding father of metabolic balance studies". Am J Nephrol. 19 (2): 226–33. doi:10.1159/000013455. PMID 10213823..
- [128]
^威廉姆斯,H. S. (1904)科学史:五卷本。第四卷:化学和生物科学的现代发展哈珀兄弟(纽约)于2007年3月26日取回.
- [129]
^Dubos J. (1951). "Louis Pasteur: Free Lance of Science, Gollancz. Quoted in Manchester K. L. (1995) Louis Pasteur (1822–1895)—chance and the prepared mind". Trends Biotechnol. 13 (12): 511–515. doi:10.1016/S0167-7799(00)89014-9. PMID 8595136..
- [130]
^Kinne-Saffran E, Kinne R (1999). "Vitalism and synthesis of urea. From Friedrich Wöhler to Hans A. Krebs". Am J Nephrol. 19 (2): 290–4. doi:10.1159/000013463. PMID 10213830..
- [131]
^爱德华·比希纳于2007年3月20日在http://nobelprize.org 发表的1907年诺贝尔演讲.
- [132]
^Kornberg H (2000). "Krebs and his trinity of cycles". Nat Rev Mol Cell Biol. 1 (3): 225–8. doi:10.1038/35043073. PMID 11252898..
- [133]
^Krebs HA, Henseleit K (1932). "Untersuchungen über die Harnstoffbildung im tierkorper". Z. Physiol. Chem. 210 (1–2): 33–66. doi:10.1515/bchm2.1932.210.1-2.33. Krebs H, Johnson W (April 1937). "Metabolism of ketonic acids in animal tissues". Biochem J. 31 (4): 645–60. doi:10.1042/bj0310645. PMC 1266984. PMID 16746382..
- [134]
^Kornberg H, Krebs H (1957). "Synthesis of cell constituents from C2-units by a modified tricarboxylic acid cycle". Nature. 179 (4568): 988–91. Bibcode:1957Natur.179..988K. doi:10.1038/179988a0. PMID 13430766..
暂无